Otrs biežākais vēža veids vīriešiem ir prostatas vēzis – lielākoties mazagresīvs, zema riska ļaundabīgs audzējs, kas visbiežāk neapdraud pacienta dzīvību. Lai prognozētu prostatas vēža tālākas attīstības risku pacienta veselībai, nozīmīga vieta ir jaunam slimības pārvaldīšanas veidam – aktīvai novērošanai.
Pacientu atlase šai metodei prasa precīzu diagnozi un rūpīgu darbu ar pacientu, izskaidrojot šādas taktikas iespējamos ieguvumus un riskus. Ievērojot kopējo prostatas vēža pacientu skaitu, to pašreizējā pārmērīgā koncentrēšana pāris iestādēs traucēs šīs mūsdienīgās slimības pārvaldīšanas taktikas ieviešanu praksē. Savukārt nepareiza prostatas vēža attīstības riska noteikšana radīs lielus, nepamatotus izdevumus pacienta dzīvību neapdraudoša vēža ārstēšanai, un sekas nepietiekama finansējuma apstākļos tam būs dzīvībai bīstamo prostatas vēža formu nepilnīga ārstēšana.
Tēmas aktualitāte
Prostatas vēzis ir viena no biežākajām vīriešu uroloģiskajām slimībām ar dažkārt lielu ietekmi uz pacienta dzīvildzi, kā arī nozīmīgu iespaidu uz valsts izdevumiem veselības aprūpē. Lai rastos aptuvens priekšstats par valsts finansējuma apjomu šai slimībai, tad tikai izdevumi hormonālajai terapijai vienā mēnesī 2011. gadā ir apmēram Ls 250 000 vai gada laikā apmēram 3 miljoni latu jeb 4% no valsts finansējuma kompensējamajiem medikamentiem. Medicīniskajā periodikā šīs slimības atsevišķi jautājumi ir regulāri apskatīti, radot iespaidu par labi izpētītu un apgūtu problēmu. Bet pēdējo 25 gadu periods, ko aizsāka masveida PSA analīzes izmantošana, mainījusi izpratni par šo slimību. Savukārt tas mainīja šīs slimības pārvaldīšanu ar no tā izrietošām sekām prostatas vēža diagnostikas un ārstēšanas algoritmā. Jācer, ka šīs izmaiņas sāks ieviesties arī Latvijā, izskaužot iepriekšējās prostatas vēža slimības pārvaldīšanas trūkumus, vienlaikus izmantojot pozitīvās iestrādes.
Prostatas vēža dabiskā norise
Prostatas vēzis ir pavadonis lielas daļas vīriešu novecošanai. Vēža šūnas prostatā histoloģiski var atrast 50 gadu vecumā 30% vīriešu, bet 80 gadu vecumā 50% [3], pēc citiem datiem 20 gadu vecumā 10% vīriešu. [12] Centrālā molekula, kas nosaka gan prostatas vēža rašanos, gan hormonālās terapijas efektivitāti, gan prostatas vēža refraktivitātes rašanos, ir nevis kāds no androgēnu grupas hormoniem, bet androgēnu receptors. [7] Prostatas vēzis lielākajā daļā gadījumu ir hroniska slimība, bez riska pacienta dzīvībai, retākos gadījumos - dzīvību apdraudoša slimība. Tomēr 10% no visām vēža izraisītajām nāvēm vīriešiem ir prostatas vēža dēļ. [16]
Vai prostatas vēža skrīnings ir izmaksu efektīvs?
Pēdējos gadu desmitos visās pasaules valstīs ievērojami pieaudzis jaunu prostatas vēža gadījumu skaits. [5] Proti, uzlabojusies šīs slimības diagnostika, kas veicinājusi pacientu skaita pieaugumu, nevis pieaudzis prostatas adenokarcinomas šūnu nēsāšanas biežums vīriešu vidū. Pirms PSA ēras liela daļa mūsdienās diagnosticēto slimības gadījumu netiktu konstatēti un liela daļa vīriešu tāpat kā iepriekš būtu miruši no citām slimībām. To apstiprina statistika par saslimstības un mirstības izmaiņām pēdējās desmitgadēs. [1; 2]. Attēlā ir dati no Somijas vēža reģistra par prostatas vēža biežumu un letalitāti 1962.-2005. gadā.
![Pēc vecuma samēroti saslimstības un mirstības rādītāji no prostatas vēža uz 100 000 persongadiem Somijā 1962.–2005. gadā [13]](https://cdn.doctus.lv/media/2011/12/2/original/00165d24b287.jpg)
![Pēc vecuma samēroti saslimstības un mirstības rādītāji no prostatas vēža uz 100 000 persongadiem Somijā 1962.–2005. gadā [13]](https://cdn.doctus.lv/media/2011/12/2/original/00165d24b287.jpg)
Attēls
Pēc vecuma samēroti saslimstības un mirstības rādītāji no prostatas vēža uz 100 000 persongadiem Somijā 1962.–2005. gadā [13]
PSA ēras sākumā straujais prostatas vēža saslimstības datu pieaugums radīja domu par prostatas vēža skrīninga ne pie cieša mību. Skrīninga nepieciešamība arī ta gad ir diskusijas objekts, bet pārdomas rada skrīninga sekas. Prostatas vēža skrīnings:
- var radīt ievērojamu nepieciešamā finansējuma pieaugumu, lai nodrošinātu nākamos soļus pēc diagnozes noteikšanas;
- var neradīt pietiekamu ar vēzi saistītās letalitātes samazinājumu.
Piemēram, ja Latvijā pēc Centrālās statistikas pārvaldes datiem 2005. gadā vecumgrupā no 50 līdz 70 gadiem ir apmēram 240 000 vīriešu, tad, lai gada laikā veiktu tikai skrīninga apskati (DRI un PSA), tas prasītu nepārtrauktu 31 urologa darbu gada garumā (31 urologs ir puse no visiem Latvijas urologiem kopā ar rezidentiem), valsts šim pasākumam tērētu ~ 3,5 miljonus latu. Visi pasākumi - prostatas biopsijas, to komplikāciju ārstēšana, operācijas, apstarošana, inkontinences un erekcijas traucējumu ārstēšana, hormonterapija, ķīmijterapija, paliatīvā terapija - izmaksās vairākus desmitus miljonus latu. Un rezultāts no nepārtrauktā procesa būtu neliels vēža specifiskās mirstības samazinājums, kas pa rā dī tos pēc 10-15 gadiem. Apkopojot datus par prostatas vēža skrīningu, zināms ieguvums no tā ir iespējams, bet jāapšauba, vai skrīninga tiešās un netiešās izmaksas Latvijai ir paceļamas.
Vai ārstēšanai ir gaidītais rezultāts?
Prostatas vēža ārstēšanai PSA ērā bieži ir statistiski neapmierinošs rezultāts: nav attiecīga mirstības samazinājuma, lai gan ir agrīnas diagnostikas pieaugums. Par iemeslu neapmierinošiem ārstēšanas rezultātiem bija vienveidīga ārstēšanas taktika prostatas vēža gadījumā, pārsvarā vadoties tikai no audzēja T stadijas, kas vienkāršoti nozīmē šo: ja vēzis lokalizēts - lokāla radikāla terapija, ja vēzis izplatīts - hormonterapija, ja refraktārs - paliatīva vai izmisuma (salvage) ķīmijterapija. Otru būtisku faktoru ārstēšanas rezultātu prognozei 1990. gadu otrajā pusē viens no pirmajiem konstatēja Lu-Yao [6], izmantojot SEER (Surveillance of Epidemiology and End Results) datubāzi par apmēram 60 000 lokalizēta prostatas vēža gadījumiem. Viņš konstatēja, ka 10 gadu vēža specifiskā izdzīvotība būtiski atšķiras dažādas agresivitātes (G1 - augsti diferencēts vēzis - zema agresivitāte; G3 - zemas diferenciācijas vēzis - augsti agresīvs) lokalizēta prostatas vēža gadījumos (skat. tabulu).
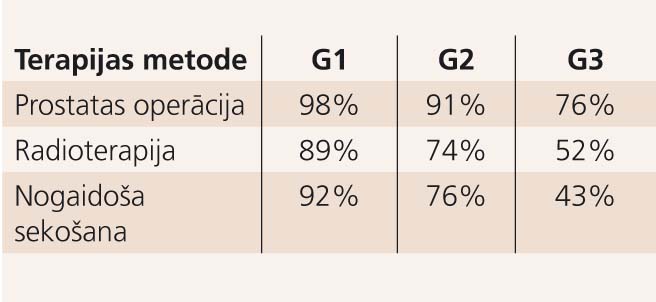

Tabula
10 gadu vēža specifiskā izdzīvotība, samērota pēc terapijas metodes un vēža histoloģiskās gradācijas
Līdzīgus rezultātus kā Lu-Yao 2003. gadā publicēja Skardino, kas konstatēja: ar nogaidošas sekošanas taktiku lokalizēta prostatas vēža gadījumā 10 gadu izdzīvotība ir 87%, ja prostatas vēzis ir neagresīvs, 34% - ja agresīvs. [4]
Vēža agresivitāte
Šo un daudzu citu pētījumu rezultāti norāda uz otru būtisku prostatas vēža raksturotāju - vēža agresivitāti. Ja sākumā agresivitātes klasifikācijai izmantoja Pasaules Veselības organizācijas sistēmu trīs pakāpēs, tad nākamie pētījumi pierādīja tās nepietiekamo precizitāti, īpaši vidējas agresivitātes grupā. Tāpēc mūsdienās izmanto 1966. gadā publicēto Minesotas Veterānu slimnīcas uroloģijas klīnikas vadītāja Glīsona (Donald Gleason) klasifikāciju, kas prostatas vēzi pēc tā audu arhitektonikas dala piecās agresivitātes pakāpēs, ko apzīmē ar terminu "Glīsona skaitlis". Lai pilnīgāk raksturotu vēža agresivitāti, pieņemts izmantot histoloģiskajā materiālā divu visvairāk izplatīto vēža agresivitātes tipu summu, tā saukto Glīsona summu (Gleason score). Pēc šīs klasifikācijas histoloģiski prostatas vēzi var iedalīt:
- neagresīvā- Glīsona summa 2-4;
- vidēji agresīvā- Glīsona summa 5-7 (3+4);
- agresīvā- Glīsona summa 7(4+3)-10. Pie agresīviem pieskaita arī prostatas vēzi ar Glīsona summu 7, kur 4. pakāpes izmaiņas ir vairāk nekā3, t.i., 4+3.
Papildus Glīsona sistēmā atsevišķos gadījumos sāk noteikt terciāro tipu, īpaši, ja tas ir zemas diferenciācijas un var mainīt ārstēšanas taktiku vai pārsniedz 5% no kopējā prostatas vēža daudzuma. Ja pacients pirms operācijas ir lietojis ADT vai 5ARI, pašreizējās zināšanas un pētījumi neļauj Glīsona skalu uzskatīt par objektīvu. Tā Bostviks [14] norāda, ka pēc neoadjuvantās hormonterapijas operācijas materiālā atrasta prostatas ļaundabīga šūna, ievērojot audu patomorfozi, jānovērtē ar Glīsona skaitli 4 un summu 8 (4+4).
Ņemot to visu vērā, prostatas vēzi iedala lokālā vai izplatītā (TNM klasifikācija). Lokālo vēzi iedala 3 vēža progresa riska grupās pēc vairākiem rādītājiem (T stadija, Glīsona summa, izejas PSA):
- zema progresa riska prostatas vēzis: T1-T2a, Glīsona summa
- vidēja progresa riska prostatas vēzis: T2b-T2c, Glīsona summa 6-7 (3+4), PSA 10-20;
- augsta progresa riska prostatas vēzis: T3a, Glīsona summa 7(4+3)-10, PSA >20.
Izvēloties ārstēšanas metodi, jāņem vērā trīs galvenie faktori:
- prostatas vēža stadija (lokāls, izplatīts) un progresa riska grupa (lokālas slimības gadījumā);
- pacienta pašreizējais veselības stāvoklis un pašreizējo slimību prognoze;
- pacienta izpratne par savu slimību (prostatas vēzi) un vēlme akceptēt dažādu ārstēšanas metožu iespējamās blakusparādības.
Nogaidoša sekošana (watchful waiting) un aktīva novērošana (active surveillance)
Pirmais pasaules reģions, kur PSA ērā strauji mainījās prostatas vēža diagnostika un ārstēšana, ir ASV. Tur strauji pieauga agrīna diagnostika un radikālo operāciju skaits. Bet, kad pēc 10-15 gadiem novērtēja prostatas vēža specifisko mirstību, konstatēja, ka tā samazinājusies tikai nedaudz. Prostatas vēža ārstēšanas rezultātu uzlabošana prasītu vēl lielāku finansējumu, kas arī ASV ekonomikai būtu nereāli. Paralēli otrā okeāna krastā 1988. gadā Skandināvijas urologi (Scandinavian Prostate Cancer Group study No.4 jeb SPCG-4) sāka pētījumu par nogaidošas sekošanas un radikālas terapijas nozīmi lokalizēta prostatas vēža ārstēšanā. Pēc 10 gadu iekļaušanas perioda un vi dēji 12,8 gadu pētījuma perioda SPCG-4 secināja, ka pacientam līdz 65 gadu vecumam radikāla operācija samazina mirstību no prostatas vēža. Toties mazagresīva prostatas vēža gadījumā nav būtiskas atšķirības vēža veicinātajā mirstībā starp radikālās operācijas un nogaidošas sekošanas grupām. Vienlaikus nogaidošas sekošanas grupā var izdalīt apakšgrupu, kas prasa aktīvu novērošanu, lai izslēgtu novēlotu letāla prostatas vēža prognozi. [8-10] Šis pētījums radīja pamatu prostatas vēža ārstēšanas algoritma maiņai, ievērojami paplašinot novērošanas taktikas izmantošanu.
Mūsdienās primāri diagnosticētam prostatas vēzim ir trīs pārvaldīšanas metodes:
- radikāla terapija;
- paliatīva terapija līdz ar tūlītēju hormonterapiju un pasīvu novērošanu;
- aktīva novērošana- ļaujot zema (un atsevišķos gadījumos arī vidēja) riska prostatas vēža gadījumā precizēt tā agresivitāti un turpināt ārstēšanu radikālās terapijas vai paliatīvās terapijas grupā.
Nogaidoša sekošana ir pārvaldīšanas taktika, kuras laikā simptomātiskas terapijas (hormonterapija, paliatīvs TURP, staru terapija metastāžu dēļ) sākums tiek atlikts līdz slimības simptomu sākumam. Nogaidoša sekošana hormonterapijas gadījumā pēc būtības ir atliktas hormonterapijas veids.
Aktīva novērošana ir slimības pārvaldīšanas taktika, ko raksturo prognozi precizējoša izmeklēšana, proti, PSA kontrole un atkārtota prostatas biopsija. Aktīvu novērošanu izmanto ļoti zema vai zema riska prostatas vēža gadījumā, un viens no variantiem ir PSA kontrole ik 3 mēnešus pirmo gadu, tad ik 6 mēnešus un atkārtota biopsija pēc 24 mēnešiem.
Tādējādi liela daļa pacientu, kam ir lokalizēts, bet neagresīvs, un pacientiem, kam nav simpomātiski izplatīts prostatas vēzis, var atturēties no jebkādas tūlītējas terapijas. Novērtējot datus par prostatas vēža agresivitāti, terapija nebūtu vajadzīga apmēram 46,4% šīs slimības pacientu, kuru slimība būtu traktējama kā zema riska slimība. [15]
Dati par ārstēšanas efektivitāti Latvijā
No šā skatpunkta var analizēt I. Smiltēna datus par prostatas vēža ārstēšanu P. Stradiņa Klīniskās universitātes slimnīcas (PSKUS) Uroloģijas klīnikā laikposmā no 2006. līdz 2008. gadam. [11] Rakstā apskatīti tikai radikāli operētie (t.i., radikālas prostatektomijas) pacienti. No 259 operētajiem pacientiem analīzē iekļauti 257. No tiem izplatītā stadijā ir 5 (N+, Nx, M+, Mx), divas operācijas (T4) veiktas acīmredzot kā izmisuma (salvage) vai citoredukcijas mērķi. Biopsijas dati ir par 173 pacientiem (Glīsona summa
Diemžēl līdzīgi dati par ārstēšanas metodēm, nemaz nerunājot par rezultātiem, manas drīz jau 30 gadu prakses laikā onkoloģiskās iestādes (dispanseri, LOC) nav sniegušas. Tāpēc jāuzslavē Stradiņa slimnīcas Uroloģijas centrs, kur strādā dr. I. Smiltēns, kas pirmais ir publiskojis vismaz kaut kādus reālus datus par prostatas vēža ārstēšanu Latvijā. Presē pārsvarā nonāk dati par saslimstības pieaugumu, pieaugošu diagnostiku vēlīnās stadijās, cilvēku bezatbildību, bet ne vārda par mirstības rādītājiem atbilstīgi stadijai un terapijas metodei, ne vārda par urologu vai ģimenes ārstu kļūdu iemesliem un to statistiku, bet beigās aicinājums - palīdzību meklējiet tur un tur.
Mūsdienu risinājumi prostatas vēža diagnostikā un ārstēšanā
Galvenais uzdevums mūsdienās ir precīzi noteikt prostatas vēža stadiju TNMG klasifikācijā un pareizi noteikt lokāla prostatas vēža progresa risku, prostatas vēzi dalot trīs vēža progresa riska grupās.
Lai veiktu šo uzdevumu, ne tikai labi jāpārzina prostatas vēža diagnostika un ārstēšana, ne tikai jāizvēlas piemērotas un nepieciešamas izmeklēšanas metodes, bet vajadzīga arī laba sadarbība ar diagnostikā iesaistītajiem speciālistiem - radiologu-diagnostu un patologu. Īpaši jāizceļ laba sadarbība ar patologu, jo lielāko daļu slēdzienu un tālāko darbību pamato vien patologa bieži vien vienpersoniskais slēdziens.
Turpinot domu par galveno uzdevumu, proti, no kopējā prostatas vēža šūnas nēsātāju vidus izdalīt pacientus ar agresīvu prostatas vēzi, pašreiz būtiski būtu vismaz ieviest lokāla prostatas vēža dalījumu trīs grupās: augsta riska un zema riska slimībā ar skaidru tālāko taktiku, attiecīgi - radikālu terapiju un novērošanu (aktīvu un pasīvu). Vislielāko problēmu rada vidējas agresivitātes audzēji, ko vajadzētu aplūkot ļoti individuāli un uzmanīgi.
Precīzas vēža stadijas un prognozes noteikšanas nozīme ir paredzēt slimības norisi un izvēlēties optimālo novērošanas vai terapijas shēmu, tādējādi netērējot naudu, kur nevajag, bet ieguldot to maksimāli agresīva prostatas vēža ārstēšanā.
Prostatas vēža pārvaldīšana Latvijā
Cenšoties aprakstīt Latvijas modeli palīdzības sniegšanā pacientiem ar prostatas onkoloģiju, patērēju vairākas dienas, uzrakstīju apmēram četrus variantus, tā arī nespējot aprakstīt šo modeli. Beigās sapratu, ka, īpaši raugoties no pacienta redzespunkta, šāda mo de ļa vai sistēmas nav. Ir empīriska, no padomju gadiem pār ņemta sis tē ma: pacients dodas pie tā ārsta, kuru uzskata par zinīgāko šajā jomā, - urologa vai onkologa. Tālākais ir atkarīgs no iestādes nosaukuma, no tās tiesībām sniegt palīdzību, ko tai deleģējusi valsts, un finansējuma apmēriem, pieejamās aparatūras, ārstu apgūtajām terapijas metodēm. Par visiem šiem faktoriem, kas reizēm nosaka ārstēšanas metodi, pacientam bieži vien nav pat nojausmas. Papildu mulsumu pacientā izsauc rinda uz konsultāciju un iespēja apiet šo rindu gan ar oficiālu, gan neoficiālu maksas konsultāciju.
Pašreizējo sistēmu raksturo pārmērīga centralizācija. Gadiem ilgi tika proponēts, ka jebkurā gadījumā ar aizdomām uz prostatas vēzi pacients jāsūta uz onkoloģisku iestādi. Inercei ir liela nozīme, un, domāju, ja 100 ģimenes ārstiem jautātu, kur sūtīt pacientu ar šādām aizdomām, vismaz 50% teiktu - uz onkoloģijas centru. Paralēli pārmērīgai centralizācijai šī pieeja izraisa:
- medicīnas fragmentāciju- pacients tiek sadalīts problēmās, orgānos, atsevišķās slimībās, bet reti tiek domāts par pacienta vispārējo labklājību;
- speciālistu procedurālistu rašanās. Valsts apmaksas sistēmā ārstam izdevīgāk ir veikt kādu procedūru (sonogrāfiju, biopsiju, operāciju), nevis strādāt ar pacientu- izskaidrot slimības īpatnības, iespējamo ārstēšanu, blaknes, ietekmi uz veselību.
Tāpēc rodas problēmas:
- pacientam paredzētajās 15minūtēs nevar izrunāt ne pusi no nepieciešamā, lai izvēlētos tālākās darbības;
- onkoloģiskās iestādes netiek galā ar pacientu skaitu- ir rindas kā uz konsultāciju, tā uz izmeklējumiem. Daļēji tas saistīts ar to, ka daļa urologu neveic pamatdiagnostikas metodi (biopsiju), bet nosūta pacientu uz šīm iestādēm;
- nozīme ir attālumam līdz ārstam, īpaši ņemot vērā, ka nereti nepieciešamas atkārtotas vizītes pie ārsta;
- onkoiestādes koncentrē pieeju dažiem ārstēšanas veidiem- staru terapijai un ķīmijterapijai. No aparatūras izmantošanas viedokļa tas ir pareizs princips, bet būtisks pieejas mehānisms, kas ir onkoloģiskais konsilijs. Katrs urologs, kas nestrādā iestādē, kur notiek konsilijs, var pastāstīt par problēmām un par pacienta ceļiem un neceļiem līdz ārstēšanai.
Latvijas Urologu asociācija centusies šīs slimības diagnostikā un ārstēšanā radīt zināmu kārtību, apmēram pirms 10 gadiem ieviešot prostatas vēža vadlīnijas, kas asociācijas biedriem ir saistošas. Diemžēl, tā kā trūkst kontroles sistēmai, kas saistītos ar resertifikācijas procesu, lielā mērā šīs vadlīnijas vairāk ir aprakstīts papīrs. Zināms mēģinājums mainīt šo sistēmu un prostatas vēža pacientu norobežošanu no uroloģijas pacienta ir uroloģijas klīniku veidošanās universitāšu slimnīcās (PSKUS un RAKUS), par kuru plusiem un mīnusiem, par iegūto pieredzi varētu gaidīt rakstu no to vadītājiem.
Kopsavilkums
- Prostatas vēža ārstēšana prasa precīzu diagnozi un prognozi.
- Prostatas vēža pārvaldīšanas metodes ir radikāla ārstēšana, paliatīva ārstēšana un aktīva novērošana.
- Galvenā problēma prostatas vēža gadījumā ir nevis vispār diagnosticēt šo slimību, bet nepalaist garām tās agresīvās formas, kas arī maksimāli agresīvi jāārstē.
- Prostatas vēža agresīvās formas efektīva ārstēšana iespējama tikai tās agrīnas diagnostikas gadījumā, kas, savukārt, iespējams tikai tad, ja ir pietiekams skaits (30-40) ārstu, kas orientējas šajā situācija un nodarbojas ar šiem pacientiem. Šādu ārstu skaitu nenodrošina pašradīta subspecialitāte "onkologs-urologs". Lielāka iespēja agrīnai diagnostikai ir pamatspecialitātes "urologs" ietvaros. Bet tikai ģimenes ārsta labāka izpratne un sadarbība ar urologu par šīs slimības raksturu sniedz cerību uz labu iznākumu.
- Prostatas vēža agresīvās formas nelokalizētos gadījumos prasa daudzdisciplināru pieeju.
- Aktīvas novērošanas un nogaidošas sekošanas iekļaušana slimības pārvaldīšanā nesamazinās kopējos finansiālos izdevumus, bet pārkārtos, iespējams, pēc paaudzes uzlabojot vēža specifiskās mirstības rādītājus.
Vienkārši īstenojami pasākumi
Lai raksts nebūtu pārāk teorētisks, lūk, daži vienkārši īstenojami pasākumi.
- Sākot ārstēšanu pirmo reizi diagnosticētam pacientam ar prostatas vēzi, kā vispārēju kārtību noteikt otra urologa slēdzienu. To neaizvieto onkoloģiskais konsilijs, jo tajā piedalās viens urologs.
- Patologa slēdzienam vajadzīgi divi paraksti.
- Neviena prostatas biopsija bez DRI pirms tās.
- Ārsta darbu, kas nav ziņojis par jaunu slimības gadījumu Vēža reģistram, valsts neapmaksā.
- Lai palielinātu prostatas vēža diagnostikas iespējas, pacientam sniegto medicīnisko palīdzību, ko veicis sertificēts urologs, apmaksā vienādi neatkarīgi no iestādes nosaukuma (princips "nauda seko pacientam").
Literatūra
- Oliver SE, May MT, Gunnell D. International trends in prostate cancer mortality in the „PSA era". Int J Cancer, 2001; 92: 893-898.
- Bosetti C, Bertuccio P, Chatenoud L, et al. Trends in mortality from urologic cancers in Europe, 1970- 2008. Eur Urology, 2011; 60: 1-15.
- Scardino PT. Early detection of prostate cancer. Urol Clin North Am, 1989; 16: 635-655.
- Chodak GW, Thisted RA, Gerber GS, et al. Results of conservative management of clinically localized prostate cancer. N Engl J Med, 1994; 330: 242-248.
- Jemal A, Murray T, Samuels A, et al. Cancer statistics, 2003. CA Cancer J Clin, 2003; 53: 25- 26.
- Lu-Yao GL, Yao SL. Population-based study of long-term survival in patient with clinically localized prostate cancer. Lancet, 1997; 349: 906-910.
- Linja MJ, Visakorpi T. Alterations of androgen receptor in prostate cancer. J Stroid Biochem Mol Biol, 2004; 92: 255- 264.
- Holmberg L, Bill-Axelson A, Helgeson I, et al. A randomized trial comparing radical prostatectomy with watchful waiting in eaarly prostate cancer. N Engl J Med, 2002; 347: 781-789.
- Bill-Axelson A, Holmberg L, Ruutu M, et al. Radical prostatectomy versus watchful waiting in early prostate cancer. N Engl J Med, 2005; 352: 1977-1984.
- Bill-Axelson A, Holmberg L, Ruutu M, et al. Radical prostatectomy versus watchful waiting in early prostate cancer. N Engl J Med, 2011; 364: 1708-1717.
- Smiltēns I. Aktualitātes prostatas vēža terapijā. LĀ, 2011/6: 38-41.
- Sakr WA, Haas GP, Cassin BF, et al. The frequency of carcinoma and intraepithelial neoplasia of the prostate in young male patients. J Urol, 1993; 150: 379-385.
- http://www.uta.fi/ibt/TPCRP
- Bostwick DG, Qian J, Civantos F, et al. Does finesteride alter pathology of the prostate and cancer grading? Clin Prostate Cancer, 2004; 2: 228-235.
- Cooperberg MR, Broering JM, Kantoff PW, et al. Contemporary trends in low risk prostate cancer: risk assessment and treatment. J Urol, 2007; 170(pt2): S 14-19.
- Hankey BF, Feuer EJ, Clegg LX, et al. Cancer surveillance series. J Natl Cancer Inst, 1999; 91: 1017-1024.