Lai gan šo slimību sākotnēji uzskatīja par retu, tagad tās sastopamības rādītājs vispārējā populācijā tiek lēsts no 1 : 200 līdz 1 : 500, un jaunākie pētījumi liecina, ka patiesais skaits varētu būt ievērojami lielāks, jo daudzi slimības gadījumi netiek savlaicīgi atklāti. HKMP iedala divās formās: obstruktīva HKMP (oHKMP) un neobstruktīva HKMP. [2]
Histoloģiskā līmenī HKMP raksturo kardiomiocītu hipertrofija, kā arī intersticiālas fibrozes perēkļi. Šīs izmaiņas visbiežāk saistītas ar klīniski nozīmīgiem variantiem gēnos, kas kodē sarkomēru struktūras proteīnus — sirds muskuļa kontraktilā aparāta daļu.
HKMP tiek pārmantota autosomāli dominantā veidā, tātad katram bērnam ir 50 % iespēja pārmantot šo slimību izraisošo gēnu, ja vienam no vecākiem atklāts kāds no gēnu variantiem, kas saistīti ar HKMP. Daļai pacientu slimība fenotipiski neizpaužas, bet citiem simptomi attīstās jau agrīni. Retāk, īpaši slimības vēlīnās stadijās, var parādīties ortopnoja vai nakts paroksismāla dispnoja, kas liecina par sirds mazspējas progresēšanu.
Lai gan mūsdienās vairākums pacientu ar HKMP var sasniegt paredzamo dzīves ilgumu, pastāv arī būtiski riski. No tiem visbīstamākā ir pēkšņa kardiāla nāve, īpaši jauniešiem un sportistiem.
Citas smagas komplikācijas ir progresējoša sirds mazspēja un trombemboliski insulti, ko veicina ar HKMP saistītā priekškambaru mirdzēšana (PM). Tomēr HKMP mirstības rādītājs ievērojami samazinājies, pateicoties savlaicīgai diagnostikai, mērķtiecīgai riska stratifikācijai un atbilstošai ārstēšanai: implantējamiem kardioversijas defibrilatoriem (ICD), invazīvām procedūrām un jaunākās paaudzes medikamentiem, piemēram, mavakamtēnam. Pašlaik mirstības rādītājs aprēķināts ~ 0,5 % gadā, kas ir līdzīgs vispārējai populācijai, ja izvēlēta atbilstoša terapija un pacienti regulāri tiek novēroti. [2; 4]
Diagnostika
HKMP pieaugušajiem tiek apstiprināta, ja miokarda sieniņas biezums sasniedz vismaz 15 mm, izslēdzot citus kreisā kambara pārslodzes iemeslus. Pirmās pakāpes radiniekiem ar zināmu HKMP ģimenes anamnēzē diagnozi var noteikt, miokarda sieniņas biezumam sasniedzot vismaz 13 mm. [4] HKMP diagnostikā galvenā nozīme ir attēldiagnostikas metodēm, īpaši ehokardiogrāfijai un sirds MR.
Transtorakālā ehokardiogrāfija
Šī pirmās izvēles attēldiagnostikas metode HKMP diagnostikā ļauj novērtēt kambaru starpsienas un citu kreisā kambara (KK) segmentu sieniņu biezumu, identificēt asimetrisku miokarda hipertrofiju, izvērtēt kreisā kambara izplūdes trakta (KKIT) obstrukciju. Ja maksimālais gradients ir < 30 mmHg, bet pacientam ir sūdzības, jāapsver provokatīvu manevru vai slodzes ehokardiogrāfijas veikšana. Kritēriji nozīmīgai obstrukcijai: maksimālais gradients kreisā kambara izejas traktā ≥ 30 mmHg miera stāvoklī vai ≥ 50 mmHg provokācijas laikā. [6]
Sirds magnētiskā rezonanse
![HKMP diferenciāldiagnozes pēc sirds MR izmeklējuma datiem [6]](https://cdn.doctus.lv/media/2025/05/2/original/d129b3d329e8.jpg)
![HKMP diferenciāldiagnozes pēc sirds MR izmeklējuma datiem [6]](https://cdn.doctus.lv/media/2025/05/2/original/d129b3d329e8.jpg)
1. attēls
HKMP diferenciāldiagnozes pēc sirds MR izmeklējuma datiem [6]
Ieteicama gadījumos, kad ehokardiogrāfijas kvalitāte ir nepietiekama vai nepieciešama precīzāka sirds struktūru morfoloģiskā izvērtēšana. Hipertrofiju ehokardiogrāfiski grūtāk izvērtējamās lokalizācijās, piemēram, sirds galotnē vai laterālajā sienā, var vizualizēt ar MR.
Ar vēlīnā gadolīnija uzkrāšanās (VGU) palīdzību ir iespēja noteikt miokarda fibrozi (palielināta VGU norāda uz fibrozi sirds miokardā). Tāpat HKMP pacientiem bieži novēro paaugstinātas vērtības natīvajā T1 izmeklējuma sekvencē (pirms kontrastvielas ievades), kas norāda uz difūzu kolagēna nogulsnēšanos miokardā. Pēc gadolīnija uzkrāšanās un T1 sekvences iespējams atšķirt citas HKMP diferenciāldiagnozes, piemēram, amiloidozi, Fabri slimību (1. attēls). [4]
Elektrokardiogramma
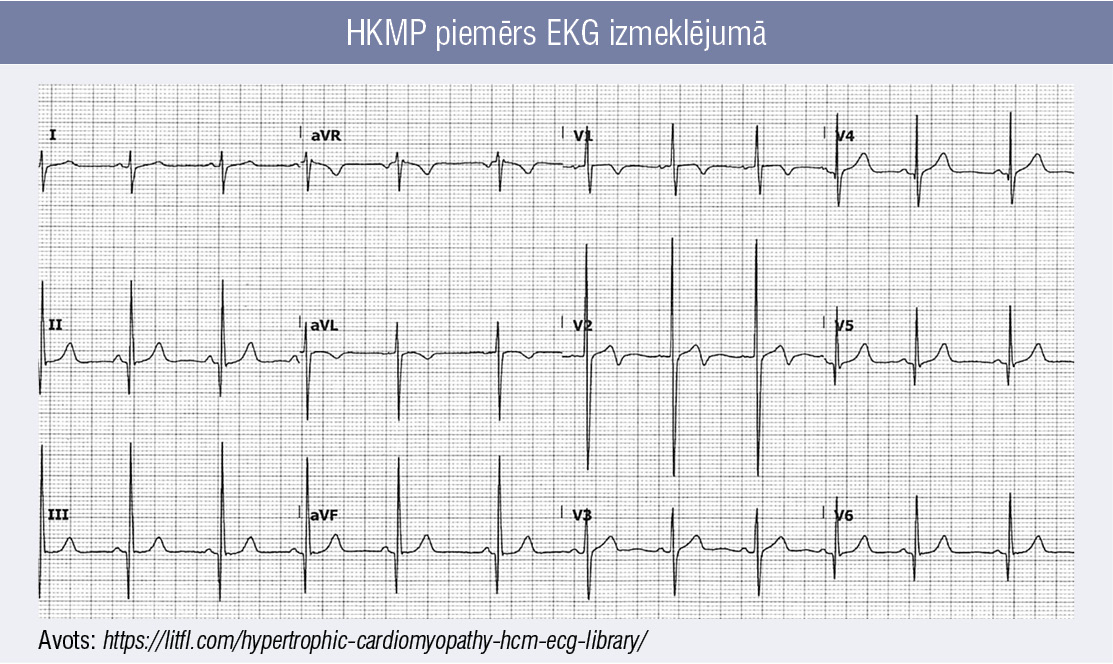

2. attēls
HKMP piemērs EKG izmeklējumā
Nozīme ir arī 12 novadījumu elektrokardiogrammai (EKG), kura kā sākotnējā izmeklēšanas metode norāda uz izmaiņām sirds miokardā. EKG izmaiņas (piemērs 2. attēlā) vērojamas 90—95 % pacientu ar HKMP, kas norāda uz:
- kreisā kambara hipertrofiju (KKH),
- ST–T izmaiņām (ST depresija un T viļņu inversijas),
- patoloģiskiem Q viļņiem,
- kreisā priekškambara palielināšanos. [5]
Kontrole ar Holtera monitoru
Būtisks izmeklējums, kas palīdz riska stratifikācijā, ir kontrole ar Holtera monitoru (HM), kad vienu vai vairākas diennaktis tiek veikts nepārtraukts EKG pieraksts. Holtera monitors palīdz savlaicīgi diagnosticēt aritmijas, kas HKMP gadījumā ir biežas un klīniski nozīmīgas.
Ap 20 % HKMP pacientu dzīves laikā attīstās PM, ievērojami palielinot insulta risku. Tāpat 20—30 % HKMP pacientu novērojamas nenoturīgas kambaru tahikardijas epizodes (NNKT), kas palielina pēkšņas kardiālas nāves (PKN) risku.
Īpaši svarīgi ir NNKT epizožu raksturlielumi, jo biežas (≥ 3 epizodes 24—48 stundās), garākas (≥ 10 kompleksu) vai ļoti ātras (≥ 200 sit./min.) tiek saistītas ar augstāku PKN risku. [6]


Tabula
Rekomendācijas sirds ritma izvērtēšanai
Amerikas Kardiologu kolēģijas/Amerikas Sirdsslimību asociācijas (ACC/AHA) 2024. gada vadlīnijas rekomendē HM veikt regulāri visiem pacientiem, kuriem ir HKMP, lai izvērtētu PKN risku un identificētu PM epizodes (tabula).
PM diagnostika ir svarīga HKMP pacientiem, jo pastāv augsts trombembolisko notikumu risks. Meta–analīzē, kurā apkopoti 33 pētījumu dati par 7381 pacientu, konstatēts trombembolijas sastopamības rādītājs HKMP pacientiem 27,09 %, bet gadījumu biežums 3,75 uz desmit pacientiem. Pacientiem ar HKMP un pastāvīgu vai paroksismālu PM ir indicēta terapija ar perorālu antikoagulantu neatkarīgi no rezultāta CHA2DS2—VA skalā. [6]
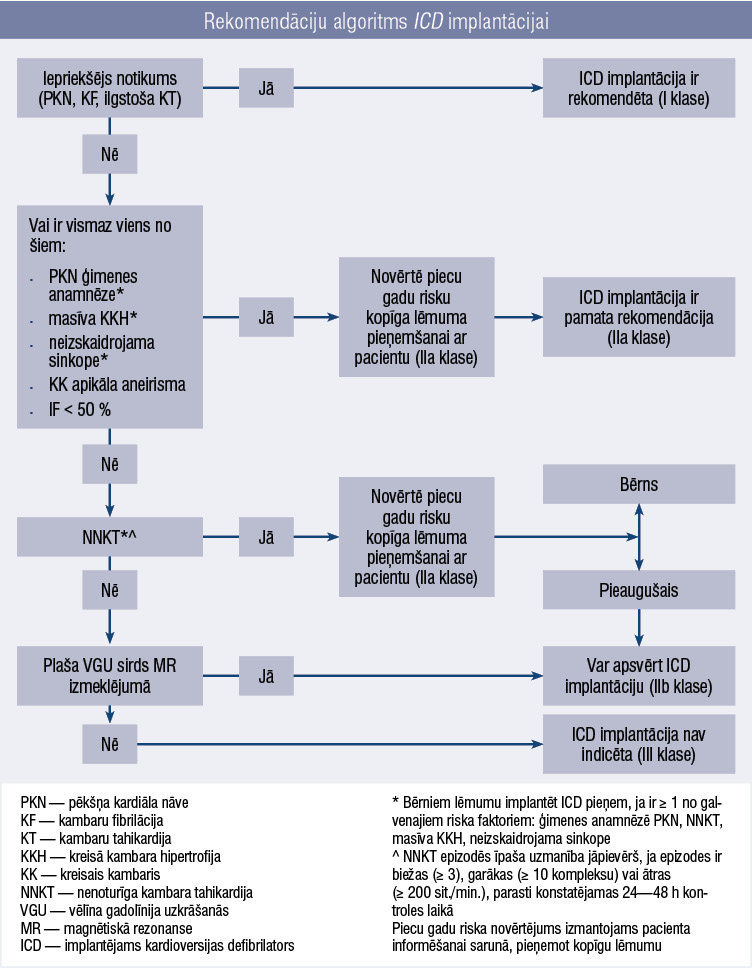

3. attēls
Rekomendāciju algoritms ICD implantācijai
Implantējamas ierīces pēkšņas kardiālas nāves profilaksei
Svarīgs aspekts pacientu ilgtermiņa riska pārvaldībā ir implantējams kardioversijas defibrilators (ICD). ICD implantē PKN profilaksei, un to iedala sekundārā profilaksē (pacientiem, kuri jau pārcietuši dzīvībai bīstamu aritmiju) un primārā profilaksē — pacientiem, kuriem vēl nav bijusi dzīvībai bīstama aritmijas epizode (piemēram, kambaru fibrilācija), bet ir augsts risks (3. attēls). [4; 9]
Ģenētiskā testēšana
Ģenētiskā testēšana ieteicama visiem pacientiem ar klīniski apstiprinātu HKMP. Praksē tiek izmantotas mērķētas gēnu paneļa analīzes, kur ar nākamās paaudzes sekvencēšanas (NGS) tehnoloģiju vienlaicīgi sekvencē vairākus gēnus, kuri visbiežāk saistīti ar HKMP. Latvijā ir iespēja veikt arī mērķtiecīgu skrīningu ģimenes locekļiem pat pirms fenotipisko pazīmju attīstības.
Ja ģimenes locekļiem ir pozitīvs ģenētiskais tests, bet nav simptomu, tad viņu atvasēm bērnu un pusaudžu vecumā ieteicama regulāra EKG un TTE pārbaude ik pēc 1—2 gadiem, bet pieaugušajiem — reizi 3—5 gados.
Svarīgi atzīmēt, ka negatīvs ģenētiskais tests vai noteikts neskaidras nozīmes ģenētiskais variants (pēc American College of Medical Genetics and Genomics vadlīnijām) neizslēdz HKMP diagnozi, un pacientiem jāturpina regulāra novērošanās pie kardiologa. [6]
Ārstēšana
HKMP terapijas taktika ir atkarīga no HKMP formas, jo obstruktīvai un neobstruktīvai formai tā atšķiras.
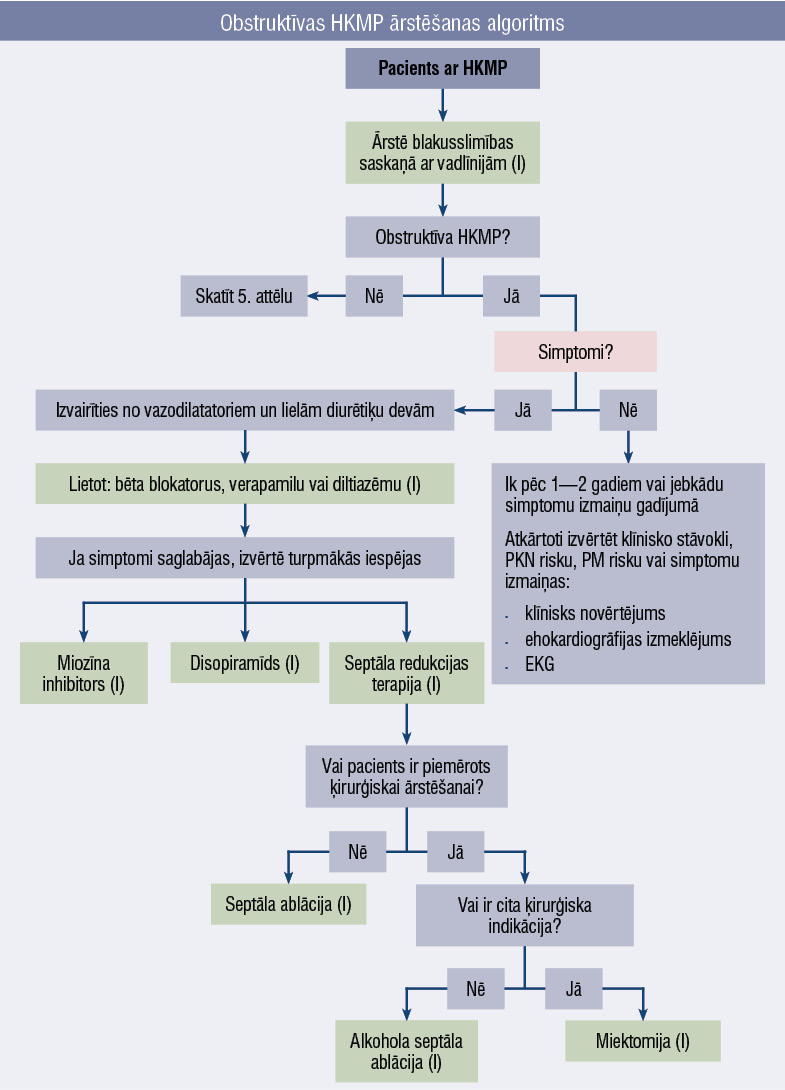

4. attēls
Obstruktīvas HKMP ārstēšanas algoritms
Obstruktīva HKMP
Terapijas taktikas izvēle oHKMP gadījumā ir atkarīga no simptomu klātienes. Asimptomātiskiem pacientiem rekomendēta dinamiska novērošana ar atkārtotu klīniskā stāvokļa izvērtēšanu ik pēc 1—2 gadiem vai simptomu parādīšanās gadījumā. Vienlaikus jāārstē blakusslimības saskaņā ar attiecīgajām vadlīnijām.
Simptomātiskiem pacientiem, piemēram, ar stenokardiju, elpas trūkumu vai sinkopi, pirmās izvēles farmakoterapija ietver bēta blokatorus.
Ja tie kontrindicēti vai ir to lietošanas nepanesība, iespējama terapija ar nedihidropiridīna kalcija kanālu blokatoriem verapamilu vai diltiazemu. Vienlaikus jāizvairās no vazodilatatoriem un lielām diurētiķu devām, jo tās var samazināt priekšslodzi un pastiprināt obstrukciju.
Ja simptomi saglabājas, jāapsver terapijas paplašināšana ar miozīna inhibitoriem, piemēram, mavakamtēnu, vai septālās redukcijas terapija — alkoholiskā septālā ablācija vai ķirurģiska miektomija. Medikamentozi rezistentos gadījumos jāapsver arī ķirurģiska iejaukšanās (4. attēls).
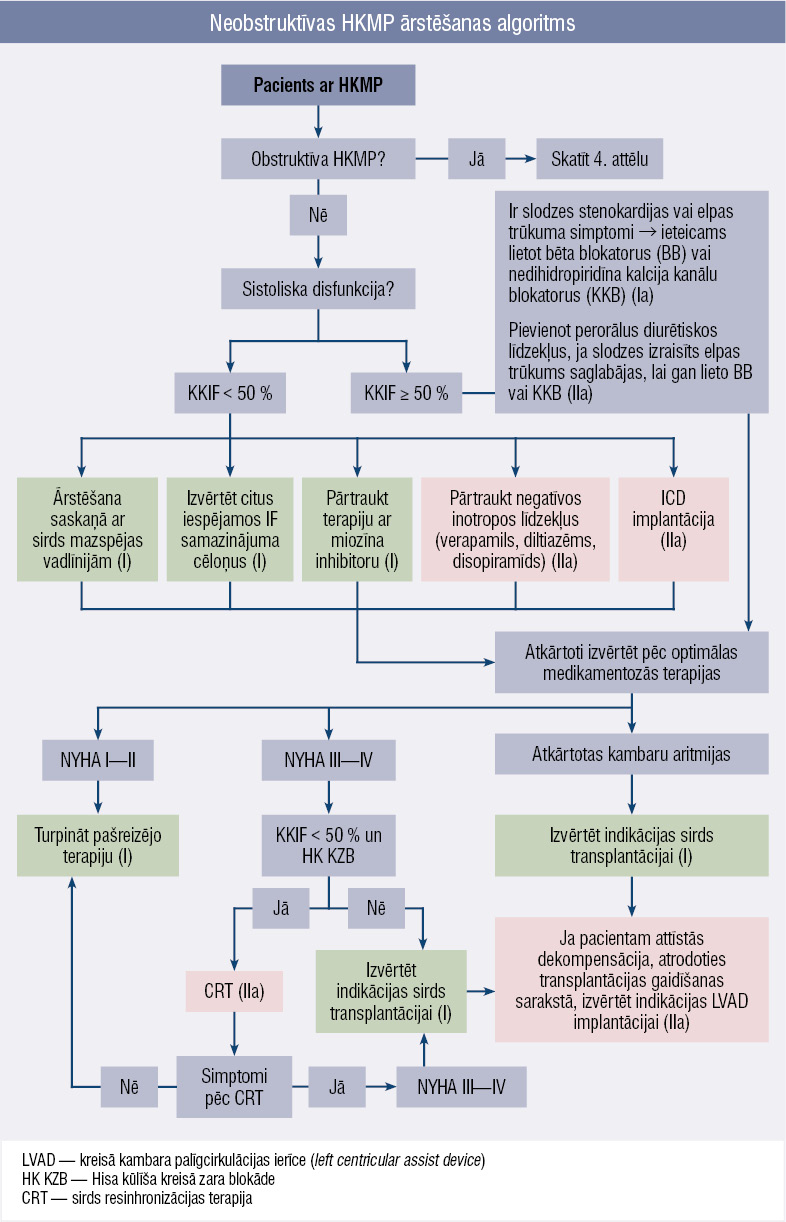

5. attēls
Neobstruktīvas HKMP ārstēšanas algoritms
Neobstruktīva HKMP
Terapeitiskās pieejas pamatā ir KK sistoliskās funkcijas un simptomu izvērtējums. Ja KK izsviedes frakcija (IF) zem 50 %, terapija jāpielāgo sirds mazspējas (HFrEF) vadlīnijām. Šādos gadījumos jāapsver arī negatīvo inotropo līdzekļu, piemēram, verapamila, diltiazema vai disopiramīda, pārtraukšana.
Savukārt pacientiem ar saglabātu IF ≥ 50 % un slodzes izraisītiem simptomiem, piemēram, stenokardiju vai elpas trūkumu, ieteicams lietot bēta blokatorus vai nedihidropiridīna kalcija kanālu blokatorus. Ja simptomi tomēr saglabājas, var pievienot perorāli lietojamos diurētiķus. Persistējošu, smagu simptomu gadījumā (III—IV funkcionālā klase pēc NYHA) jāapsver sirds transplantācija. Ja pacienta stāvoklis dekompensējas, atrodoties transplantācijas gaidīšanas sarakstā, var veikt kreisā kambara palīgcirkulācijas ierīces (LVAD) implantāciju. Neobstruktīvas HKMP terapijas taktika atainota arī
5. attēlā.
Terapijā izmantotās medikamentu grupas
HKMP gadījumā medikamentoza terapija ir pirmais solis simptomu kontrolei. Galvenās lietotās medikamentu grupas ir negatīvi hronotropi/inotropi līdzekļi, kas samazina sirdsdarbības frekvenci un kontraktilitāti, tādējādi mazinot dinamisko KKITO un to radītos simptomus.
Bēta blokatori (BB): pirmās izvēles terapija pacientiem, kuriem ir simptomātiska oHKMP. BB samazina miokarda kontraktilitāti un palēnina ritmu, tādējādi mazina KKIT gradientu un uzlabo slodzes panesību.
Nedihidropiridīna kalcija kanālu blokatori (KKB): verapamils un diltiazems, kurus lieto gadījumos, kad BB nav efektīvi vai pacienti tos netolerē. Verapamils (vai alternatīvi diltiazems) samazina miokarda kontraktilitāti un uzlabo diastolisko pildīšanos, līdzīgi kā BB mazinot obstrukcijas gradientu un simptomus. Tāpat tos var lietot neobstruktīvas HKMP simptomu mazināšanai (piemēram, stenokardijai vai slodzes dispnojai). Jāuzmanās, ja pacientam ir izteikta hipotensija vai ļoti augsts KKIT gradients (> 100 mmHg), — tad verapamils nav ieteicams. [5]
Diurētiskie līdzekļi tiek lietoti tikai neobstruktīvas HKMP gadījumā, īpaši pacientiem ar sastrēguma simptomiem. Savukārt oHKMP gadījumā diurētiķu lietošana jāizvērtē ļoti piesardzīgi — nelielās devās un tikai tad, ja ir acīmredzama šķidruma pārslodze, jo pastāv risks pastiprināt KKIT gradientu un izraisīt hemodinamisku nestabilitāti. Vadlīnijas iesaka oHKMP gadījumā izvairīties arī no diurētiķiem lielās devās, AKE inhibitoriem un citiem vazodilatatoriem. [6]
2024. gada AHA/ACC vadlīnijas rekomendē sirds miozīna inhibitoru (mavakamtēnu) pieaugušajiem ar simptomātisku oHKMP, kuriem simptomi saglabājas, lai gan pacients lieto BB vai KKB (I klases ieteikums). Sirds miozīna inhibitori ir jauna medikamentu klase HKMP terapijā. Mavakamtēns ir selektīvs, atgriezenisks sirds miozīna ATPāzes inhibitors. Tas samazina aktīna—miozīna saišu veidošanos un kardiomiocītu saraušanās spēku, mazinot to kontraktilitāti gan sistolē, gan diastolē. Tas uzlabo sirds diastolisko funkciju un samazina KKITO. [7; 8]
EXPLORER–HCM, kas bija III fāzes klīniskais pētījums, piedalījās pieaugušie ar simptomātisku oHKMP (NYHA II—III klase, KKIT gradients ≥ 50 mmHg, KK IF ≥ 55 %). Pacienti (n = 251) tika nejaušināti iedalīti grupās un 30 nedēļas saņēma mavakamtēnu vai placebo (bēta blokatoru). Primāro mērķi (slodzes jaudas pVO2 uzlabojums ≥ 1,5 ml/kg/min. + NYHA klases uzlabošanās vai pVO2 uzlabojums ≥ 3,0 ml/kg/min. bez NYHA pasliktināšanās) sasniedza 37 % mavakamtēna grupā un 17 % placebo grupā (p = 0,0005). NYHA klases uzlabojumu novēroja 65 % mavakamtēna saņēmēju un 31 % placebo grupā (p < 0,0001). Paralēli primārajam mērķim un funkcionālajiem iznākumiem pētījumā tika analizēti arī biomarķieri. Mavakamtēna grupā 30. nedēļā tika novērots būtisks pazeminājums NT–proBNP līmenī (par 80 % vairāk nekā placebo grupā; TI 0,169—0,241) un hs–cTnI līmenī (par 41 % vairāk nekā placebo grupā; TI 0,500—0,693).
Lietojot mavakamtēnu, regulāri jākontrolē KK IF. Pētījumā sistoliskās funkcijas samazinājumu novēroja ~ 5,7 % pacientu (KK IF < 50 %), taču tas bija pārejošs. [7]
Kontrindikācijas terapijai ar mavakamtēnu:
- KK IF < 55 % (terapijas laikā, ja KK IF pazeminās (< 50 %), medikamenta lietošana jāpārtrauc, un to drīkst atsākt tikai pēc KK IF atjaunošanās ≥ 50 %),
- grūtniecība,
- smagas aknu (Child—Pugh C) vai nieru (GFĀ < 15) mazspējas gadījumā mavakamtēna lietošana nav pētīta un potenciāli var nebūt droša.
Biežāk novērotās blakusparādības: reibonis (~ 27 %), nogurums, galvassāpes, elpas trūkums, sirdsklauves, ģībonis. Mijiedarbība ar citiem medikamentiem: stingri aizliegts kombinēt ar CYP2C19 vai CYP3A4 inhibitoriem (ketokonazolu u.c.) vai induktoriem (piemēram, rifampicīnu).
Kontrole terapijas laikā: KK IF un KKIT gradientu kontrole pirms terapijas sākšanas un ik pēc ~ 12 nedēļām. Terapija jāpārtrauc, ja KK IF < 50 %. [8]
Nemedikamentoza ārstēšana
Simptomātiskas oHKMP gadījumā izmanto ķirurģisku septālu miektomiju. Tā indicēta pacientiem ar smagas gaitas simptomātiku (III vai IV klase pēc NYHA), ko izraisa KKITO, un pacientiem, kam nav uzlabojuma, lietojot medikamentozu terapiju.
Miektomija īpaši piemērota, ja pacientam ir anatomiskas īpatnības, kas veicina obstrukciju (piemēram, izteikti pagarināta priekšējā mitrālā vārstuļa vira), ir līdztekus sirds slimības (piemēram, mitrālā vārstuļa stenoze, aortas vārstuļa stenoze, kas jāārstē ķirurģiski). Miektomija tiek uzskatīta par “zelta standartu” KKIT obstrukcijas novēršanai. Operācijas risks ir zems (mirstība < 1 %). Miektomija nav ieteicama asimptomātiskiem pacientiem ar labu slodzes panesību (III klases ieteikums).
Īpaši apsvērumi: lai gan septālās sienas samazināšana visbiežāk tiek veikta pacientiem ar NYHA III/IV funkcionālo klasi, vadlīnijas rekomendē apsvērt miektomiju (II b klase) arī NYHA II funkcionālās klases pacientiem ar:
- augstu KKIT gradientu (> 100 mmHg), īpaši bērniem un jauniešiem,
- smagu pulmonālu hipertensiju,
- atkārtotu priekškambaru fibrilāciju, ko izraisa obstrukcija,
- ievērojami samazinātu fizisko kapacitāti, lai gan simptomi ir mēreni.
Salīdzinot ar alkohola septālo ablāciju, miektomija nerada plašus rētaudus, tātad aritmiju risks nākotnē ir zemāks. [4]
Perkutāna alkohola septālā ablācija arī saistīta ar zemu procedūras mirstības risku (< 1 %), taču tās veikšanai nepieciešama piemērota koronāro artēriju anatomija. Šī metode ļauj izvairīties no sternotomijas, nodrošina īsāku hospitalizācijas laiku, un tā īpaši noderīga gadījumos, kad pacienta vispārējais veselības stāvoklis vai blakusslimības palielina ķirurģiskas septālas miektomijas risku. Tomēr alkohola septālā ablācija ir mazāk efektīva, ja izejas trakta gradients ≥ 100 mmHg un/vai kambaru starpsienas biezums ≥ 30 mm. Šī metode saistīta ar augstāku risku pastāvīga elektrokardiostimulatora implantācijai un nepieciešamību veikt atkārtotu ķirurģisku iejaukšanos atlieku obstrukcijas dēļ. [4]