Doctus 2022. gada decembra numurā autoru kolektīvs iepazīstināja ar niezes daudzajām sejām, uzzinājām, ka iemesls var slēpties ne tikai dermatoloģiskas, bet arī sistēmiskas vai psihiatriskas patoloģijas ēnā. Šajā turpinājumā aplūkoti vēl citi jautājumi. Kā novērtēt pacientu ar niezi? Kādi diagnostiskie kritēriji jāņem vērā? Kādas ārstēšanas metodes šobrīd ir pasaulē un Latvijā?
Pacienta izmeklēšana
Nieze ir subjektīva sajūta, kuras smagumu un esību nevar novērtēt objektīvi. [18] 1. tabulā piedāvāts apkopojums par iespējamiem instrumentiem niezes novērtēšanā. Lai pareizi diagnosticētu pamatslimību, kas izprovocē hronisku niezi, nepieciešama strukturēta un sistematizēta, kā arī multidisciplināra pieeja, kas ietver pacienta anamnēzi, klīnisko apskati, laboratoriskos izmeklējumus.
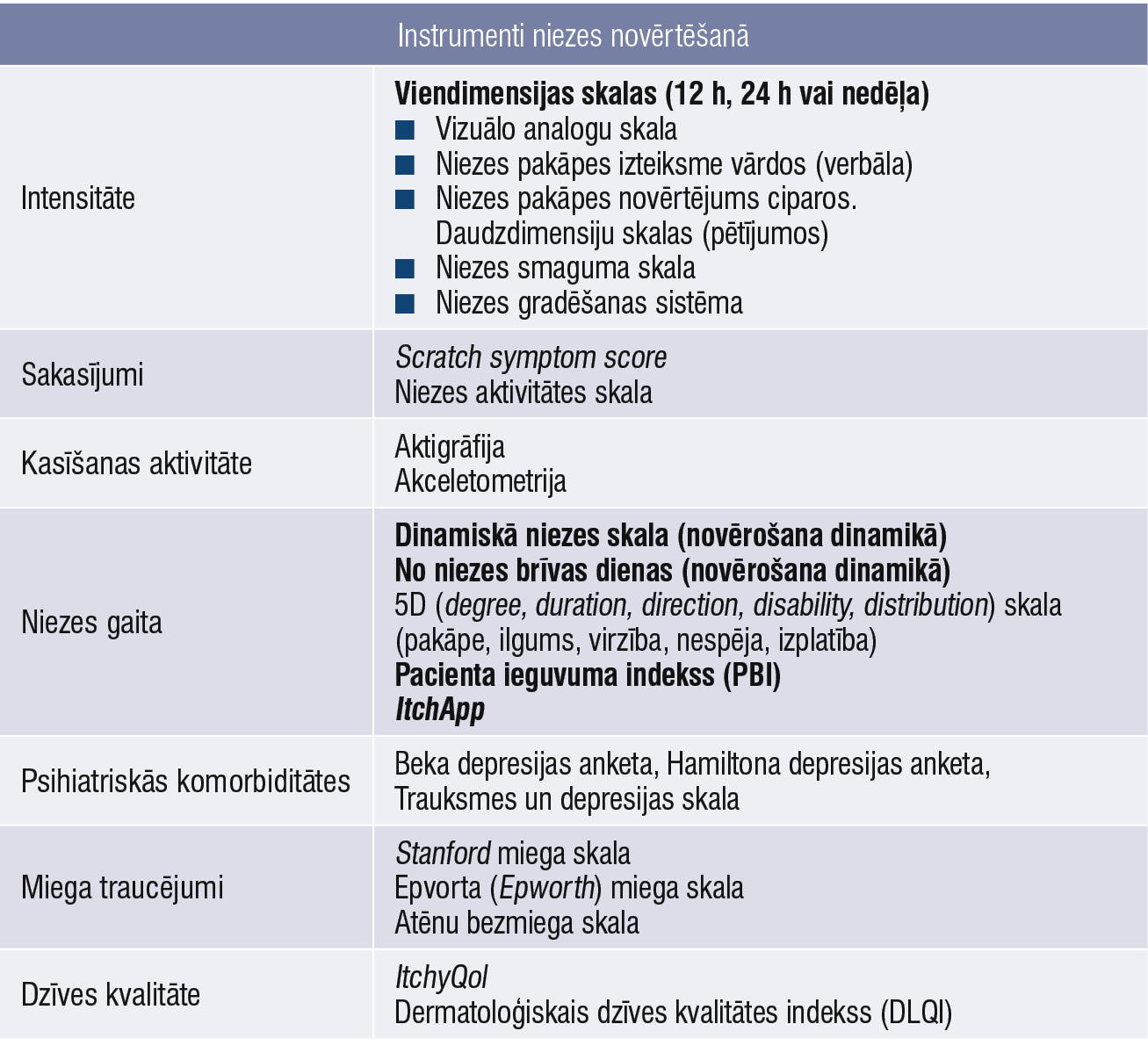

1. tabula
Instrumenti niezes novērtēšanā
Ļoti būtiski parametri ir niezes intensitāte. Monodimensionālas skalas (vizuālo analogu vai verbālās) palīdz objektivizēt niezes sajūtu, atzīmēt atskaites punktu. Skalas rādījums obligāti jāatzīmē pirmajā vizītē un dinamiskajā novērošanā. Par labdabīgu niezes gaitu, intensitātes mazināšanos liecina arī no niezes brīvās dienas, ja vien pacients veic ierakstus niezes dienasgrāmatā vai atzīmē simptomus viedierīču lietotnē, piemēram, ItchApp.
Pacientam piedāvā aizpildīt anketas ar jautājumiem par niezes raksturu (1. attēls), blakusslimībām, dzīves kvalitāti, piemēram, ItchyQol vai DLQI, kā arī trauksmes un depresijas skalas un pacienta ieguvuma indeksa (PBI) anketu. [19]
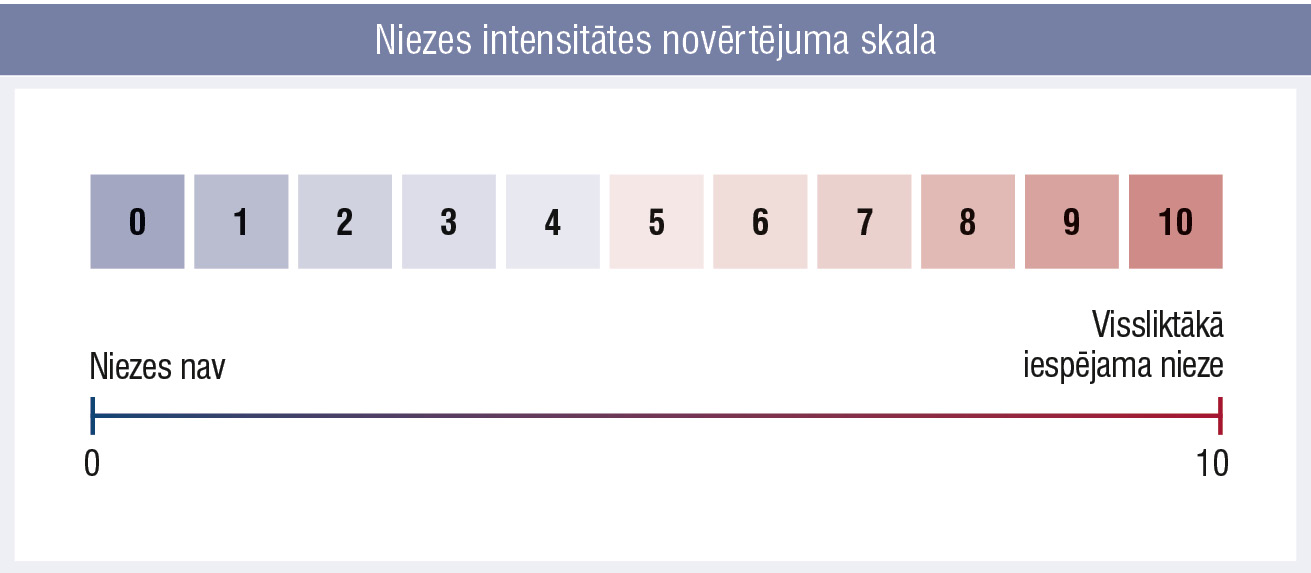

1. attēls
Niezes intensitātes novērtējuma skala
Pirmajā vizītē pacients jāapskata no galvas līdz kājām, lai klīniski klasificētu pēc Starptautiskā Niezes izpētes foruma (International Forum for the Study of Itch — IFSI) klasifikācijas (sk. iepriekš), izslēgtu ādas slimības. Nepieciešamības gadījumā var lietot mikoloģiskus izmeklējumus, dermatoskopiju vai pacienta apskati zem Vuda lampas. [20] Anamnēze un anketēšana palīdzēs diferencēt, pie kuras grupas pacients pieder (2. attēls).


2. attēls
Anketa “Strukturēta pieeja pacientam, kura galvenā sūdzība ir nieze”
Ļoti būtiski ir precizēt, kur nieze sākās, vai tā bijusi lokalizēta vai uzreiz ģeneralizēta. Ļoti bieži nieze sākas lokalizēti un ar laiku, slimībai progresējot, ģeneralizējas. Tas ir tipiski dermatoloģisku, sistēmisku un psihiatrisku slimību gadījumā. Neiropātisku slimību gadījumā jāpievērš uzmanība, ja sūdzības ir par strikti lokalizētu niezi, piemēram, brahioradiālā nieze vai notalgia paresthetica un smalko nervu šķiedru neiropātija.
Tāpat būtiski ir noteikt niezes ilgumu, jo tas var norādīt arī uz iespējamu rezistenci terapijai. Nieze, kas ilgst < 6 nedēļas (akūta nieze), ir relatīvi vieglāk ārstējama.
Pacientiem, kuri tiek klasificēti IFSI I grupā, var veikt ādas punch vai incīzijas biopsiju, bet IFSI II un III grupā klasificētajiem jāveic papildu laboratoriskie un radioloģiskie izmeklējumi. Šajā posmā ir svarīga ģimenes ārsta vai internista palīdzība. Protams, vecāka gadagājuma pacienti ir diagnostisks izaicinājums, jo viņiem vienlaicīgi varētu būt multiplas potenciāli pruritogēnas slimības, kas iepriekš ar niezi nav izpaudušās.
Jāsāk ar pamata izmeklējumiem: pilna asins aina, feritīns, EGĀ, CRO, kreatinīns, urīnviela, GFĀ, K+, urīna analīze, bilirubīns, AlAT, AsAT, GGT, SF, LDH, TSH, glikoze.
Ja tiek atklātas izmaiņas šajos radītājos, tad jāpaplašina laboratoriskie un radioloģiskie izmeklējumi. Savukārt, ja pacients klasificēts IFSI II un III grupā, bet viņam nav nekādu somatisku slimību, ir vēlama psihiatra konsultācija. [3]
Psihogēnas niezes diagnostiskie kritēriji
Psihogēna nieze nav idiopātiska nieze, un tā nav arī izslēgšanas diagnoze. Starptautiskās slimību klasifikācijas 11. redakcija starp citiem niezes cēloņiem (EC90) skaidri nodala psihogēnu niezi (EC90.4) no nezināmas izcelsmes niezes (EC90.6).
Franču psihodermatoloģijas grupa (French Psycho–Dermatology Group — FPDG) savā definīcijā piedāvā desmit diagnostiskus kritērijus (2. tabula). [13; 21]
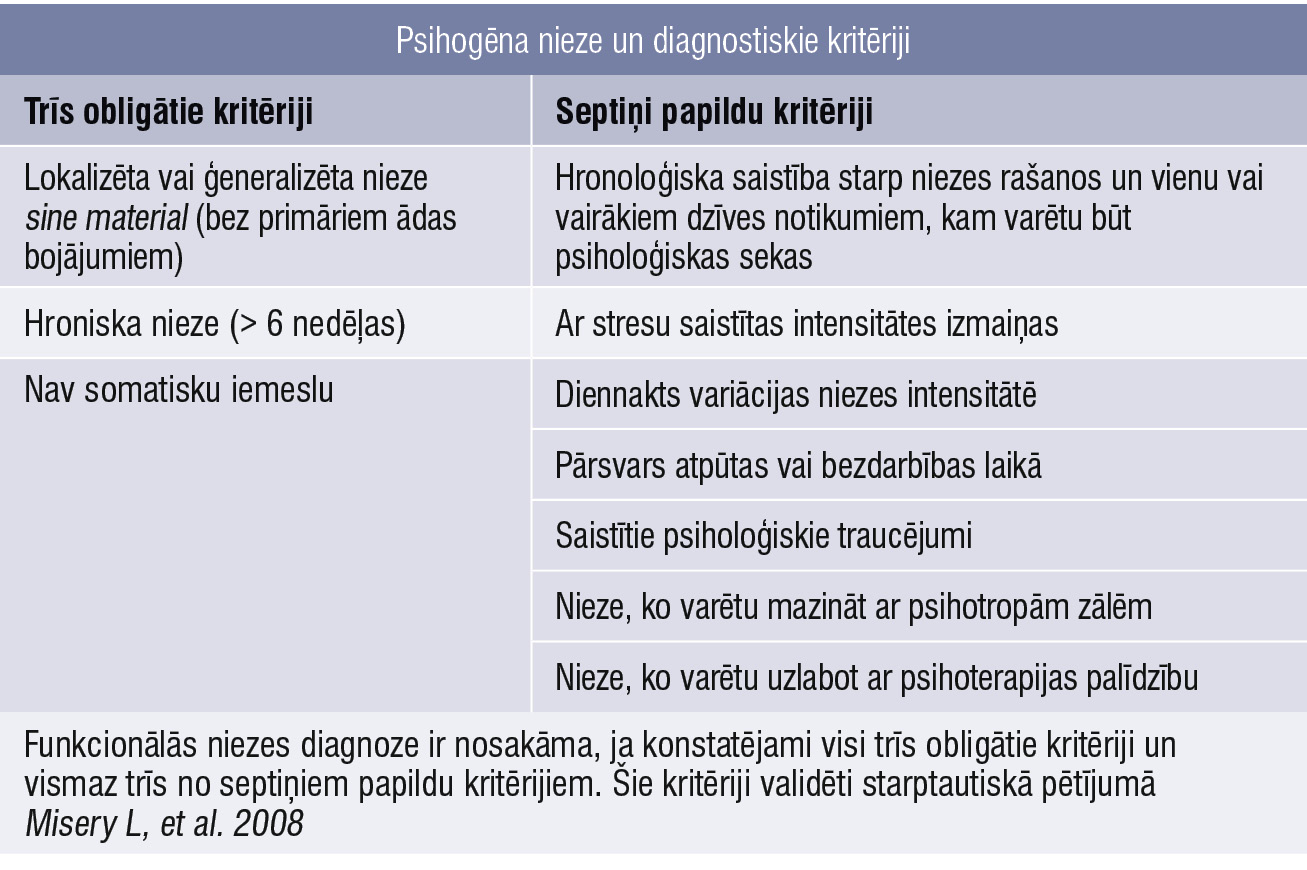

2. tabula
Psihogēna nieze un diagnostiskie kritēriji
Niezes terapijas iespējas
Dzīves kvalitāti ietekmē ne tikai nieze, bet arī tādi pavadoši stāvokļi kā miega traucējumi, psihoemocionāls stress. Arī šie faktori ir jāņem vērā, gatavojot ārstniecības plānu. Terapijai jāsākas iespējami ātrāk, lai novērstu procesa pārvēršanos hroniskā problēmā.
Smagākos gadījumos jālieto multimodāla terapija, proti, sistēmiski un lokāli līdzekļi. Simptomātisku terapiju nedrīkst pārtraukt vai mainīt pārāk agri, citādi nevar pareizi izvērtēt tās efektivitāti, piemēram, ir zināms, ka pretepilepsijas līdzekļi un antidepresanti iedarbojas attiecīgi pēc astoņām un 12 nedēļām.
Ap 65 % pacientu ar hronisku niezi tiek ārstēti ar šiem medikamentiem. Tomēr atlikušajiem 35 % šī terapija izrādās neefektīva un ir nepieciešami jauni ārstnieciskie līdzekļi.
Hroniskas niezes ārstēšanu var sadalīt trijos posmos.
1. posms — vispārējas rekomendācijas: izvairīties no palaidējfaktoriem, lietot emolientus un antihistamīnus.
2. posms — simptomātiska un mērķim adaptēta terapija: pretepilepsijas līdzekļi, antidepresanti, μ opioīdu receptoru antagonisti, imūnsupresanti. Piemēram, gabapentīns urēmiskas niezes gadījumā, holestiramīns holestātiskas niezes gadījumā.
3. posms — simptomātiska terapija: niezes indukcijas un pārvades signāla pārtraukšana. [23]
1. posmā un pat pirms analīžu rezultātu saņemšanas pacientam var sākt sistēmisku terapiju ar antihistamīniem. Ja ir miega traucējumi, priekšroka dodama sedatīviem jeb H1 antihistamīniem, dažreiz tricikliskajiem antidepresantiem. Svarīgi arī pēc dušas vai vannas uz nakti lietot emolientus.
Priekšroka jādod emolientiem ar tādām aktīvajām vielām kā urīnviela 5—10 %, glicerīns, propilēnglikols un pienskābe. Jāizvairās no tādiem alergēniem kā konservanti un parafīns, kā arī kairinātājiem, piemēram, virsmaktīvajām vielām. Pacientam ieteicams mazgāties siltā, bet ne karstā ūdenī, var izmantot auzu koloīdvannas vai kālija permanganāta vannas. Gaisa temperatūrai mājās nakts laikā jābūt zemai, apģērbam — ērtam un brīvam. Jāizvairās no pārkaršanas, pārmērīgas svīšanas, pirts, baseina apmeklējuma, pārmērīgas mazgāšanās, spirta kompresēm. Jāizvairās no asiem, karstiem ēdieniem un alkohola. [24]
Ja šie pasākumi izrādās neefektīvi, ārsts var izvēlēties 2. posma jeb mērķim adaptētu terapiju, tiklīdz ir zināmi analīžu rezultāti. 3. posmā izvēļu klāstu pārsvarā veido bioloģiskie, opioīdu receptorus modulējošie medikamenti un neirokinīna receptoru–1 antagonisti. Šajā gadījumā medikamentu lietojums ir ārpus indikācijām.
Lokāla terapija
Lokālie anestezējošie līdzekļi
Benzokaīns, lidokaīns, polidokanols iedarbojas uz dažādiem ādas receptoriem, iejaucoties perifērajā niezes transmisijas ceļā. Tos bieži lieto nolūkā ārstēt lokalizētu niezi, piemēram, neiropātisku niezi, ar HNS asociētu niezi, pēcapdeguma niezi un paraneoplastisku niezi. Diemžēl šie līdzekļi pēc lokālas uzklāšanas darbojas īslaicīgi (10 minūtes).
Cinks, mentols, kampars
Lai gan dermatoloģijā cinku tā antiseptiskās, pretniezes un pretiekaisuma iedarbības dēļ lieto jau vairāk nekā simt gadu, ir ļoti maz pētījumu, kas apstiprinātu tā efektu. Mentols, kuru koncentrācijā no 1 % līdz 10 % var izmantot pūderos, losjonos, ziedēs, ierosina aukstuma sajūtu, kam seko analgēzijas efekts, kas var ilgt ~ 70 minūtes. Mentols līdzīgi kapsaicīnam saistās ar TRPM8 receptoriem un līdzīgi kamparam ar TRPV3 receptoriem.
Kampars ir ēteriska eļļa, šķīst spirtā. Pēc uzklāšanas uz ādas izraisa siltuma sajūtu, kam seko viegla anestezējoša sajūta. Dermatoloģijā to koncentrācijā no 2 % līdz 20 % jau gadu desmitiem lieto losjona, ziedes formā. Tas specifiski aktivē TRPV3 receptorus un līdzīgi kapsaicīnam aktivē TRPV1 receptorus. Tas izskaidro, kāpēc kamparu, cinku un mentolu var lietot pacientiem ar hronisku niezi.
Kapsaicīns jeb trans–8–metil–N–vanilil–6–nonenamīds
Aso čili piparu sastāvdaļa ir lietojama kā sāpes mazinošs līdzeklis. Lokāla kapsaicīna uzklāšana aktivē C šķiedras, kas stimulē tās izdalīt neirotransmiterus, kuri inducē no devas atkarīgu eritēmu un dedzināšanas sajūtu.
Pēc atkārtotas kapsaicīna uzklāšanas dedzinošā sajūta mazinās. Toties niezes sajūta, lietojot kapsaicīnu, var saglabāties ilgstoši, pat nedēļām. Rekomendējams sākt ar lielāko devu un uzklāt biežāk. Lokālu dedzināšanu var mazināt ar lidokaīnu vai ādas atdzesēšanu.
Pacientiem ar sūdzībām par degošu skalpu var ordinēt 0,025 % kapsaicīna šķīdumu spirtā. Kapsaicīna šķīdumu mazākā koncentrācijā 0,006 % var lietot ķermeņa krokās vai pruritus ani gadījumā, bet lielākā koncentrācijā, piemēram, 8 % plāksteru formā, neiropātiskas niezes gadījumā.
Kortikosteroīdu loma
Kortikosteroīdi (lokāli) ir pirmās līnijas medikamenti iekaisīgu dermatožu gadījumā, bet nav ieteicami niezes ārstēšanā, ja nav ādas slimības.
Takrolims un pimekrolims
Lokāli kalcineirīna inhibitori (KNI) darbojas gan imunoloģiski, gan uz neironiem. Terapijas sākumā tie var inducēt pārejošu dedzināšanas sajūtu, kas varētu liecināt par TRPV1 aktivāciju. KNI ir efektīvi pretniezes līdzekļi atopiskā dermatīta gadījumā, turklāt Ung. Tacrolimusum 0,1 % ir efektīvāka nekā zemas potences kortikosteroīdi, Cr. Tacrolimusum 0,03 % un Cr. Tacrolimusum 1 %.
Klīniskie pētījumi uzrāda gan tacrolimusum, gan pimecrolimusum efektivitāti arī seborejiskā dermatīta, dzimumorgānu lichen sclerosus, kroku psoriāzes un ādas vilkēdes gadījumā.
Tacrolimusum ir efektīvs arī hroniskas lokalizētas dzimumorgānu niezes terapijā.
Sistēmiskā terapija
Antihistamīni
Visplašāk lietotie medikamenti dermatoloģijā.
Medikamenti, kas saistās ar H1 receptoriem, efektīvi var novērst akūtas niezes sajūtu urtikārijas, insektu kodumu gadījumā.
Pirmās paaudzes antihistamīni (chlorpheniramini maleas, clemastinum, cyproheptadinum, diphenhydramini hydrochloridum) var saistīties ne tikai ar H1 receptoriem, bet arī ar muskarīna, alfa adrenerģiskiem, dopamīna un serotonīna receptoriem, kam piemīt centrāls sedatīvs efekts.
Otrās paaudzes antihistamīni (cetirizini dihydrochloridum, levocetirizini dihydrochloridum, loratadinum, desloratadinum, ebastinum, fexofenadini hydrochloridum, rupatadinum, bilastinum) minimāli ietekmē vai vispār neietekmē ne–histamīnerģiskos receptorus, tiem nav vai ir neizteikts sedatīvs efekts. Hroniskas niezes gadījumā tiem ir dodama priekšroka, salīdzinot ar šaurjoslas UVB fototerapiju. Kopumā ne–sedatīvie H1 receptoru antagonisti ir efektīvi, ja hroniska nieze asociēta ar urtikāriju un mastocitozi, bet neuzrāda efektivitāti hroniskas niezes gadījumā, ko izsauc kāda sistēmiska slimība.
Tuklo šūnu inhibitori
Ketotifenum (1 mg 2 × dienā) uzrāda pretniezes efektu pacientiem ar HNS, bet mazāk nekā gabapentīns.
Glikokortikosteroīdi (GKS)
Bieži izmantojami, lai ārstētu smagu hronisku niezi, kas asociēta ar iekaisīgām dermatozēm vai sistēmiskām slimībām. Klīniskajos pētījumos nieze mazinās jau pirmajās 30 minūtēs pēc GKS intravenozas ievadīšanas urtikārijas vai medikamentu izraisītas eksantēmas gadījumā.
Ilgstoša GKS lietošana nav vēlama pacientiem ar hronisku niezi, bet īslaicīgi (< 2 nedēļas) varētu lietot, īpaši paraneoplastiskas niezes gadījumā (ādas T šūnu limfoma), jo samazina IL31 produkciju, kas korelē ar niezes smagumu.
Visbiežāk lietojams ir prednizons (no 2,5 mg līdz 100 mg, visbiežāk sākuma deva 30—40 mg/d), retāk metilprednizolons intravenozi no 500 mg līdz 1 g diennaktī. Mazinot sistēmiskās terapijas devas, jāatceras par rikošeta efektu, labāk pāriet uz lokālu GKS ievadi pārdienās.
Opioīdu receptoru modulatori
Efektīvi pret dažām niezes formām ir µ opioīdu receptoru antagonisti, piemēram, naltreksons (p.o. 50 mg/d), nalmefēns (p.o. 18 mg/d) un naloksons (intravenozi). [25] Nejaušinātos pētījumos opioīdu receptoru antagonisti ir bijuši noderīgi holestāzes niezes, HNS niezes, hroniskas nātrenes, atopiskā dermatīta un epidurālas morfīna ievadīšanas ārstēšanā. [26]
Nalfurafinum jeb κ opioīdu receptoru agonists arī uzrāda efektivitāti ar HNS asociētas niezes un urēmiskas niezes gadījumā. Preparāts pagaidām reģistrēts tikai Japānā. [23] Nalbuphinum ir vēl viens jauns, daudzsološs kombinēts medikaments (κ opioīdu receptoru agonists un μ opioīdu receptoru antagonists), kas pagaidām tiek pārbaudīts II b/III fāzes klīniskā pētījumā. [27; 28]
Pretepilepsijas līdzekļi
Gabapentīns ir pretkrampju līdzeklis un sāpju modulators, ko izmanto neiropātiju ārstēšanā. Saistoties ar perifēro un centrālo nociceptīvo neironu kalcija kanālu apakšvienībām, šī viela kavē nervu depolarizāciju. Mehānisms, ar kura palīdzību šie līdzekļi mazina niezi, nav zināms. To parasti lieto, lai ārstētu neiropātiskus traucējumus, kas saistīti ar sāpēm un niezi, [29] kā arī nezināmas izcelsmes niezi. [30; 31]
Pregabalīns ir vēl viena viela, kas uzrāda efektivitāti nezināmas izcelsmes hroniskas niezes terapijā, taču nepieciešami apstiprinoši pētījumi lielām pacientu grupām. [31]
Antidepresantu loma
Tiek uzskatīts, ka ieguvums no p.o. antidepresantiem izriet no šo zāļu ietekmes uz serotonīna un histamīna līmeni. Serotonīnam var būt niezi regulējoša loma supraspināli, caur ietekmi uz t.s. “on” un “off” šūnām nuclei raphes un caur 5–HT3 receptoru modulāciju mugurējo saknīšu ganglijos. Tomēr nejaušinātu pētījumu ir maz, lielākā daļa datu par antidepresantu efektivitāti iegūti no atklāta plānojuma pētījumiem, gadījumu ziņojumiem un gadījumu sērijām. [32]
Piemēram, nejaušinātā pētījumā, kurā piedalījās 110 pacienti, kuri tika ārstēti ar intratekālu morfīnu, profilaktiskā tetracikliskā antidepresanta mirtazapīna lietošana (15—45 mg dienā) bija saistīta ar samazinātu niezes biežumu pēc morfīna ievades. [33] Turklāt atklātā pētījumā, kurā 72 pacienti ar smagu, hronisku niezi tika ārstēti ar SSASI paroksetīnu vai fluvoksamīnu, 68 % pacientu atbildes reakcija uz ārstēšanu bija viegla, laba vai ļoti laba. [34] Sertralīns uzrāda efektivitāti holestātiskas niezes un hroniskas nieru slimības (HNS) niezes gadījumā. Amitriptilīns (25 mg dienā) uzrāda efektivitāti pacientiem ar brahioradiālo niezi.
SSASI pretniezes efekts sākas ne ātrāk par 2.—3. nedēļu un maksimumu sasniedz 4.—6. nedēļā pēc terapijas sākuma. Ātrāku pretniezes efektu var dot tikai escitaloprāms (10—40 mg dienā).
Antidepresantu blakusparādības (miegainība, nogurums, galvassāpes, kā arī kardiovaskulāri un gastrointestināli simptomi) ir biežas, vecāka gadagājuma pacientiem tie lietojami ar piesardzību. Rekomendējamās devas pacientiem ar onkoloģisku slimību: paroksetīns 20—40 mg dienā vai mirtazapīns 15—30 mg dienā, pacientiem ar holestāzi un HNS — amitriptilīns 25—50 mg dienā.
Talidomīds
TNFα antagonists, kam arī piemīt centrālas dabas niezi nomācošs efekts, tas lokāli iedarbojas uz nervu šūnu proliferāciju. Šis medikaments uzrāda labākus rezultātus tieši prurigo nodularis gadījumā (50—300 mg dienā), kā arī HNS niezes gadījumā. Medikamentam piemīt teratogēns efekts, kā arī no devas atkarīga, bet pārejoša neiropātija (> 100 mg dienā).
Imūnsupresanti
Ciklosporīns A ir vienīgais līdzeklis, kas apstiprināts atopiskā dermatīta niezes terapijā. Metotreksāts uzrāda efektivitāti pacientiem ar psoriātisku niezi. Azatioprīns uzrāda efektivitāti pacientiem ar bullozām dermatozēm (50—200 mg dienā). Metotreksāta efekts uz hronisku niezi galvenokārt dokumentēts retrospektīvos gadījuma aprakstos.
Neirokinīna receptoru–1 antagonisti
P viela spēlē galveno lomu niezes indukcijā pēc tās izdalīšanās no sensoriem neironiem. P viela pēc savienošanās ar neirokinīna–1 receptoru (NK1R) uz keratinocītiem, tuklajām šūnām, neironiem, dendrītiskajām un endotēlija šūnām palaiž neirogēnu iekaisumu un tuklo šūnu degranulāciju, kas pastiprina niezes signālu.
Ādas P vielas līmenis ir paaugstināts, galvenokārt stāvokļos, kad notiek ādas nervu hiperplāzija, — atopiskā dermatīta, prurigo nodularis gadījumā. Dažos aprakstos atzīmēta aprepitantum pretniezes iedarbība ādas T šūnu limfomas, medikamentu izraisītas niezes, paraneoplastiskas niezes gadījumā. Jauns NKR1 antagonists serlopitantum uzrāda labāku efektivitāti hroniska prurigo gadījumā un labu panesamību.
Bioloģiskie medikamenti
Omalizumabum — humanizēta, rekombinēta monoklonālā antiviela specifiski saistās ar IgE smagās ķēdes Cε3 domēnu. Omalizumabum tādējādi samazina brīvā IgE līmeni, kā arī samazina augstas afinitātes IgE receptoru blīvumu, kas ir nepieciešami tuklo šūnu un bazofilu aktivācijā un degranulācijā. Omalizumabum 2014. gadā Eiropā (300 mg) un ASV (150 mg un 300 mg) tika apstiprināts hroniskas spontānas urtikārijas ārstēšanā, kas ir nejutīga pret H1 antihistamīniem, pieaugušajiem un bērniem virs 12 gadu vecuma. [24]
Dupilumabum — cilvēka monoklonālā antiviela pret IL4 receptoru alfa uzrāda efektivitāti atopiskā dermatīta hroniskas niezes gadījumā, arī prurigo nodularis gadījumā.
Nemolizumabum — monoklonāls IL31 receptora antagonists — uzrāda efektivitāti hroniskas niezes ārstēšanā. [23] Sistemātiskos pārskatos anti–IL17, JAK inhibitori (tofacitinibum, baricitinibum), adalimumabum, apremilastum — efektīvi novērš niezi psoriāzes un atopiskā dermatīta pacientiem. Ir nepieciešami papildu pētījumi, kas pierādītu efektivitāti hroniskas niezes ārstēšanā.
Fototerapija
UVA un UVB fototerapiju var rekomendēt pacientiem ar hronisku niezi gan iekaisīgu dermatožu, gan ādas limfomas, gan sistēmisku slimību gadījumā (ar HNS asociētas niezes, urēmiskas un akvagēnas niezes). Rekomendējams kombinēt fototerapiju ar lokālo un/vai sistēmisko terapiju, izņemot terapiju ar kalcineirīna inhibitoriem un imūnsupresantiem. [24]
Antipsihotiskie līdzekļi
Jānozīmē visos gadījumos, kad niezi un sakasījumus rada psihotiska simptomātika, bet jāatzīmē arī cits iespējamais ieguvums. Atalgojuma sistēmas neironu ķēde ir pamatā circulus vitiousus “niezes—kasīšanas” procesam, kad rodas vēlme kasīt ādu, lai sasniegtu “patiku” no niezes remdēšanas, un veidojas zināmā mērā atkarību izraisoša uzvedība. [31] Šo dopamīnerģisko atalgojuma sistēmu var ietekmēt dopamīna sistēmu ietekmējošie antipsihotiskie līdzekļi, piemēram, pimozīds vai risperidons un olanzapīns.
Psihosomatiskā terapija
Adjuvantas psihosociālas programmas, kas fokusējas uz hroniskas niezes pacientiem ar atopisko dermatītu, ir visefektīvākās, līdzīgas programmas ir izveidotas pacientiem ar hronisku niezi. Īpaši efektīvas tās ir pacientiem ar depresīviem traucējumiem. [24]