Pasaulē šobrīd nav specifiskas mērķa terapijas medikamentu pret koronavīrusu SARS–CoV–2, bet vakcinācija ir sākusies limitētā apjomā. Laboratoriskā diagnostika ir noteicošā pandēmijas ierobežošanai. Covid–19 testēšana Latvijā tika sākta 29.01.2020.
Diagnostisko antivielu reaģentu komplektu ražošana sākta salīdzinoši nesen, tāpēc nepieciešams veikt pētījumu par antivielu iespējamo klātbūtni, veidošanās dinamiku un imūnās aizsardzības ilgumu dažādām pacientu grupām Latvijā.
Apkopojot SARS–CoV–2 infekcijas diagnostikas pieredzi E. Gulbja laboratorijā un zinātnisko pētījumu publikāciju datus, raksts sniedz ieskatu par aktuālo situāciju Covid–19 seroloģiskajā diagnostikā.
Pētījuma mērķis
Noteikt un raksturot specifisku antivielu pret SARS–CoV–2 vīrusu veidošanās dinamiku un to saglabāšanos ilgtermiņā. Iegūt sākotnējos datus populācijas seroprevalencei.
Ar trim dažādām diagnostiskajām metodēm noteikt SARS–CoV–2 antivielu klātbūtni un raksturot rezultātu saistības. Iegūtie dati ļautu noteikt pacientu grupas, kam izveidojušās antivielas, to veidošanās procesu (periodu no saslimšanas, izveseļošanās, simptomu pazušanas brīža) un izskaidrot konstatētos rādītājus. Šie dati būtu izmantojami seroepidemioloģiskiem slēdzieniem par Latvijas iedzīvotāju imunizācijas līmeni attiecībā uz Covid–19 noteiktā laikā.
Pētījuma metodes un gaita
Pētījuma pamata metode ir retrospektīva laboratorisko rezultātu analīze laboratorijā (konkrēti — E. Gulbja laboratorijā), kur 25.02.2020. tika sākta Covid–19 diagnostika, ar RL–PĶR metodi nosakot SARS–CoV–2 vīrusa RNS nazofaringeālos un orofaringeālos paraugos. Pirmo RNS pozitīvo SARS–CoV–2 testu laboratorijā identificēja 3.03.2020. Līdz ar pirmo pozitīvo gadījumu laboratorijā tika sākta antivielu testēšana un šo metožu validēšana pacientiem, kas slimo ar Covid–19, un kontaktpersonām no pacienta mājsaimniecības.
No 1. jūnija kopējo anti SARS–CoV–2 antivielu testa veikšana tika piedāvāta rutīnas izmeklējumu ietvaros, īpaši pacientiem, kas laboratorijā ieradās uz RL–PĶR SARS–Cov–2 vīrusa noteikšanas testu. Lai izvērtētu specifisko antivielu veidošanās dinamiku un noturību ilgtermiņā, laboratorija sāka pētījumu Covid–19 pozitīvo pacientu un viņu kontaktpersonu grupai.
Paraugu veidi un pacientu atlase
Paraugi SARS–CoV–2 vīrusa RNS noteikšanai ar RL–PĶR bija nazofaringeālās un orofaringeālās iztriepes. Seruma paraugi antivielu testiem tika iegūti standarta savākšanas sistēmās. Pacientu grupas:
- pacienti, kas pārslimojuši koronavīrusu SARS–CoV–2 vai slimo (RL–PĶR pozitīvie), viņu seroloģisko materiālu iegūstot slimošanas laikā un noteiktu periodu pēc izveseļošanās;
- pacientu dzīvesbiedri, bērni, vecāki u.c. personas, kas dzīvo vienā mājsaimniecībā ciešā kontaktā ar inficētajiem pacientiem, neievērojot pilnīgu izolēšanos, tomēr nesaslimst;
- pacienti, kam no 2019. gada septembra līdz 2020. gada novembrim bijušas slimības ar līdzīgiem simptomiem kā SARS–CoV–2 infekcijai, un līdz šim nesaslimuši pacienti bez zināma kontakta ar pozitīvu SARS–CoV–2 slimnieku.
Brīvprātīgo grupai, kas piekrita ilgstošai antivielu testēšanai (34 pacienti) ar laboratoriski apstiprinātu SARS–CoV–2 infekciju, atkārtotie antivielu testi tika veikti vidēji ik pēc 22 dienām. Pētījumā iekļautajai pacientu grupai kopā veikti 637 testi: 179 kopējo anti SARS–CoV–2 antivielu testi un 458 IgA un IgG klases specifisko antivielu testi. Pētījuma grupā piedalās 15 sievietes un 19 vīrieši vecumā no 18 līdz 66 gadiem.
Izmantotās laboratoriskās metodes
Antivielu noteikšanas testi
IgA un IgG antivielas pret S1 (spike1) proteīniem (Euroimmune, Vācija) noteiktas ar ELISA metodi. Testi veikti automatizētā ELISA mikroplašu testēšanas sistēmā: BEP2000 Advance System (Siemens Healthcare Diagnostic Products GmbH, Vācija). Kopējās anti SARS–CoV–2 antivielas pret N–nucleocapsid proteīniem (Roche Diagnostics, Šveice) noteiktas ar elektrohemiluminiscences metodi. Testi tika veikti automatizētā imūnķīmijas sistēmā Cobas 8000 (Roche Diagnostics, Šveice).
Rezultāti
Tika apkopota antivielu veidošanās dinamika atkārtotos mērījumos izvēlētai pacientu grupai, analizējot to kopā ar simptomu ilgumu un RNS pozitivitāti dienās no novērojumu sākuma.
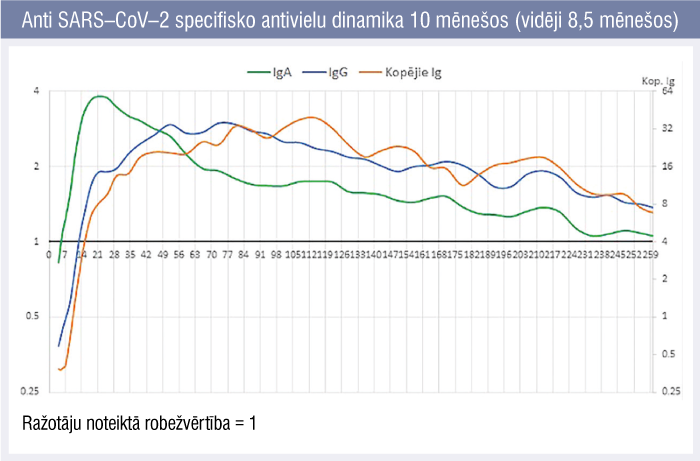
Analizējot un salīdzinot atsevišķu pacientu antivielu veidošanās dinamiku, tika novērota izteikti individuāla humorālās imunitātes atbildes reakcija uz SARS–CoV–2 vīrusu kā antigēnu. Veicot visu pacientu datu aproksimāciju, praktiski pierādījās pieņēmums par atsevišķu antivielu klašu veidošanās secību un dinamiku (1. attēls).

1. attēls
Anti SARS–CoV–2 specifisko antivielu dinamika 10 mēnešos (vidēji 8,5 mēnešos)
IgA klases antivielas veidojas ātrāk — ir nosakāmas vidēji 5.—6. saslimšanas dienā un sāk mazināties pēc 21 dienas. IgG klases antivielas seruma paraugos parādās vidēji 10.—12. dienā un no 50.—60. dienas pakāpeniski samazinās. Līdzīga dinamika vērojama kopējo imūnglobulīnu testam. Visas izmantotās metodes uzskatāmi rāda, ka specifiskās antivielas pret SARS–CoV–2 stabili saglabājas novērojuma veikšanas laikā, — desmit mēnešus pēc saslimšanas.
Svarīgi ir izvērtēt dažādu antivielu testu rezultātus konkrētam pacientam, jo strukturālu īpatnību vai molekulas telpiskās struktūras dēļ kāds no mērķa proteīniem var būt mazāk nosakāms, jo ir ierobežota ekspresija. Rezultāti rāda, ka atsevišķos gadījumos, kad pret S1 proteīnu modelētie testi uzrāda robežvērtību vai vāji pozitīvu rezultātu, šim paraugam tiek iegūta pārliecinoši pozitīva vērtība ar testu, kam mērķa antigēns ir N–nucleocapsid proteīnu virkne.
Tika apkopoti kopējo anti SARS–CoV–2 antivielu rezultāti rutīnas pacientu grupai, kas vēlējās noteikt specifiskās antivielas pret SARS–CoV–2 vai piekrita antivielu izmeklējumam, veicot RL–PĶR testu. Analīze veidota pēc 18 349 testiem (9959 kopējās antivielas (Roche), 2776 IgA un 5614 IgG klases antivielas (Euroimmun)). Konstatētā kopējo antivielu pozitivitāte rutīnas pacientiem, salīdzinot pa mēnešiem, pieauga proporcionāli saslimušo skaitam (no 2,4 % jūnijā, 8,3 % augustā, 13,3 % oktobrī līdz 34,6 % decembrī). Jāņem vērā, ka šī seroprevalence ir noteikta pacientu grupai, kam bija pamatotas aizdomas veikt izmeklējumus (simptomi, kontakts ar Covid–19, ceļojums u.c.)
Diskusija
Imūnās sistēmas atbilde uz infekcijas izraisītāju SARS–CoV–2 atkarīga no daudziem faktoriem un ir individuāla katram slimniekam. Statistiski vidējos rādītājus iespējams tikai modelēt. [1] Būtiskākie faktori, kas var ietekmēt inficēšanos un slimības norises gaitu:
- vīrusa slodze — cik daudz infekciozā aģenta inficēšanās brīdī nokļūst organismā,
- cilvēka šūnu “uzņēmība” — atkarīga no AKE2 receptoru ekspresijas, serīna transmembrānu proteāzes u.c. faktoriem, kas nodrošina vīrusa iekļūšanu mērķa šūnās,
- sākotnējās celulārās un sekretori humorālās imūnās atbildes reakcija (IgA specifiskas antivielas elpceļu sekrētos u.c.),
- blakusslimības un stāvokļi, kas supresīvi ietekmē imunitāti. [2]
Pacienti ar asimptomātisku slimības gaitu var atbrīvoties no vīrusa ātrāk nekā pacienti ar simptomiem, un antivielu titri asimptomātiskajos gadījumos, visticamāk, ir zemāki nekā inficētiem pacientiem, kuriem ir simptomi. Šie ir apsvērumi jebkuras SARS–CoV–2 vīrusa seroepidemioloģiskās izmeklēšanas interpretācijai. [3]
Antivielu, t.i., humorālās imunitātes, veidošanās ir atkarīga no vīrusa slodzes un klīnisko izpausmju smaguma pakāpes.
Konstatēts, ka izteikti zemāka seropozitivitāte ir asimptomātiskajiem vīrusa nēsātājiem, salīdzinot ar ambulatorajiem slimniekiem un hospitalizētajiem pacientiem (attiecīgi 15,4 % pret 81 % un 100 %, anti SARS–CoV–2 IgG testam). [4]
Būtiska loma sākotnējai reakcijai pret vīrusa invāziju ir sekretorajām IgA klases antivielām. Iespējams, tieši šīs antivielas ir pirmās, kas specifiski saista vīrusu gļotādās, neļaujot tam iekļūt šūnās. [5] Tas daļēji var skaidrot faktu, ka indivīdi, kas dzīvo kopā ar Covid–19 pacientiem, nesaslimst un neuzrāda nedz pozitīvu RL–PĶR testu nazofaringeālajos paraugos, nedz pozitīvus antivielu testus serumā. Ir publicēti dati par noteiktām specifiskajām IgA antivielām serozajos paraugos (siekalās, asarās, deguna izdalījumos) veselības aprūpes darbiniekiem, kas kontaktē ar Covid–19 inficētiem pacientiem. [6] Optimālākais laiks antivielu noteikšanai serumā — sākot ar trešo nedēļu pēc saslimšanas. [7; 8]
Antivielu testu rezultātu interpretācijā jāņem vērā konkrētas personas izmeklējums uz SARS–CoV–2 vīrusu ar RL–PĶR, klīniskās norises veids, simptomu smagums un epidemioloģiskā informācija. Šobrīd lietotie antivielu testi ir puskvantitatīvi, to skaitliskajām vērtībām ir tikai orientējoša nozīme, kas tieši nekorelē ar specifisko antivielu daudzumu un aizsargspēju. Testu puskvantitatīvās vērtības nav salīdzināmas dažādām imūnglobulīnu klasēm. Tās var lietot, lai izvērtētu atsevišķa pacienta imūnās atbildes reakcijas dinamiku. Nozīme ir ražotāja izvēlētajam antigēna veidam, pret kuru izstrādātās antivielas tiek meklētas paraugā.
Tiek uzskatīts, ka lielākā daļa neitralizējošo antivielu, kas nodrošina aizsargreakciju pret vīrusu, ir antivielas pret Spike proteīniem. Tātad antivielu testus, kas veidoti pret Spike kā antigēnu, varētu izmantot vakcinācijas efektivitātes noteikšanai.
Starptautiskās klīniskās ķīmijas federācijas (IFCC) darba grupas vadlīnijās [9] teikts, ka antivielu noteikšanu pret SARS–CoV–2 A1 rekomendāciju līmenī var lietot:
- kā papildu diagnostisko rīku pacientiem ar klīniski izteiktām aizdomām par Covid–19, ja laiks no simptomu sākuma ir 14 dienas un vairāk, bet ir negatīvi vai vāji pozitīvi RL–PĶR testi nazofaringeālajos paraugos (arī gadījumos, ja molekulārais tests nav veikts);
- kā papildu diagnostisko rīku pacientiem ar ilgstoši pozitīviem RL–PĶR testiem nazofaringeālajos paraugos, lai apstiprinātu imūnās atbildes veidošanos, kad pacienti vairs nav uzskatāmi par infekcioziem;
- kā papildu rīku pediatrijā multisistēmiskā iekaisuma sindroma (multi-system inflammatory syndrome in children) diagnostikā.
Tiklīdz būs uzkrāts pietiekams apjoms pierādījumu, antivielu potenciāls lietojums nākotnē varētu būt šādos gadījumos:
- lai noteiktu iepriekš bijušu inficēšanos nehospitalizētiem simptomātiskiem vai asimptomātiskiem pacientiem un novērtētu sabiedrības seroprevalenci;
- kvantitatīvi novērtētu antivielu imūnās atbildes līmeni Covid–19 pacientiem;
- kā palīgrīku, atlasot konvaliscentās plazmas donorus;
- lai novērtētu imunitātes veidošanos pēc vakcinācijas;
- lai uzraudzītu iedzīvotāju kopējās imunizācijas līmeni.
Antivielu noteikšanu pret SARS–CoV–2 nevar izmantot, lai apstiprinātu akūtu saslimšanu ar Covid–19 (0.—< 14. slimības diena) vai lai atļautu nelietot individuālos aizsarglīdzekļus darbiniekiem, kas kontaktē ar iespējamiem Covid–19 slimniekiem.
Iegūto datu izvērtējumā jāņem vērā zināmi ierobežojumi. Pētījuma pacientu grupā netika ietverti smagi Covid–19 pacienti, kas ārstējās stacionārā. Seroprevalence noteikta atsevišķai pacientu grupai apstākļos, kad saslimšanas ar Covid–19 sastopamība ir zema.
Izmantotās antivielu noteikšanas metodes ir puskvantitatīvas. Antivielu testiem saskaņā ar mūsu laboratorijā iegūtajiem datiem 2—3 % gadījumu ir iespējami viltus pozitīvi rezultāti krustenisku vai nespecifisku reakciju dēļ.
Secinājumi
Antivielas pret SARS–CoV–2 vīrusu vismaz desmit mēnešus pēc pārslimošanas saglabājas nosakāmā līmenī. Vidēji tās parādās 6.—10. dienā pēc simptomu sākšanās. Optimālais laiks antivielu testu veikšanai ir no 2.—3. saslimšanas nedēļas.
Antivielas izveidojas pacientiem, kuru mērķa šūnās antigēns ir iekļuvis un imūnās sistēmas šūnas to ir identificējušas. Imūnā atbildes reakcija pēc inficēšanās ar SARS–CoV–2 vīrusu ir individuāla un atkarīga no daudziem faktoriem. Antivielu serokonversijas dinamika ir “klasiska” — IgA parādās un samazinās ātrāk par IgG.
Antivielu dinamikas izvērtējumā svarīgi ir salīdzināt un mērījumiem lietot dažādu klašu un mērķa proteīnu diagnostiskos testus ciešā kontekstā ar epidemioloģisko informāciju un klīniskajām izpausmēm. Vienlaicīgi veicot RL–PĶR un antivielu testus, ir iespēja iegūt tūlītēju informāciju par to, vai pacients ir inficēts, potenciāli infekciozs, orientējoši noteikt infekcijas stadiju. Šos datus var izmantot, lai pieņemtu lēmumu par izolācijas vai karantīnas pārtraukšanu un atgriešanos darbā.
Svarīgi laboratoriju praksē izvērtēt antivielu noteikšanas testsistēmu klīnisko veiktspēju, praktiski verificēt jutību un specifiskumu. Lai noteiktu seropozitivitāti zemas izplatības populācijā, sijājošā diagnostikā jālieto augsti specifiski antivielu testi.
Antivielas pēc vakcinācijas. Ieskats turpmākajos pētījumos
Pētījuma dalībniekiem, kuri 2021. gada janvārī saņēma vakcīnu, arī tika veikti antivielu testi.
Kopumā testēti 85 vakcinētie medicīnas darbinieki, katram veikti trīs antivielu mērījumi: pirms vakcinācijas, 21 dienu pēc vakcīnas 1. devas un septiņas dienas pēc vakcīnas 2. devas. Tika izmantoti seši dažādi antivielu testi no trīs ražotājiem.
Rezultāti
Pirms vakcinācijas 84 dalībniekiem visi antivielu testu rezultāti bija negatīvi. Viena kolēģe bija pārslimojusi Covid–19, un visi veiktie testi uzrādīja pozitīvas specifiskās antivielas pret SARS–CoV–2 vīrusu.
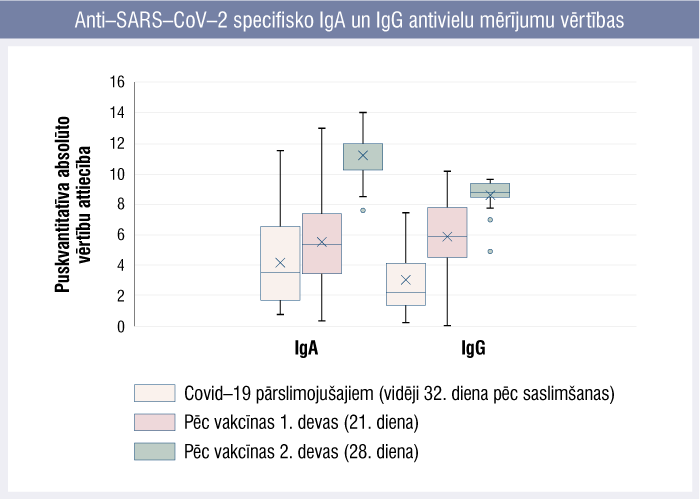
Antivielas dažādos apjomos bija nosakāmas 21 dienu pēc vakcīnas 1. devas. Tikai vienai kolēģei antivielu nebija. Nedēļu pēc vakcīnas 2. devas visiem tika novērots ievērojams visu pret Spike vērsto antivielu pieaugums (2. attēls).

2. attēls
Anti–SARS–CoV–2 specifisko IgA un IgG antivielu mērījumu vērtības
Secinājumi
Pēc vakcīnas divu devu saņemšanas veidojas specifiskas antivielas pret SARS–CoV–2 vīrusa Spike proteīniem izteiktā apjomā, kas ļauj cerēt uz efektīvu humorālo aizsardzību. Antivielu līmenis vakcinētajām personām ir ievērojami augstāks nekā Covid–19 slimniekiem. Jāņem vērā, ka vakcinācija stimulē tikai anti–Spike antivielu veidošanos. Pārslimojot vīrusinfekciju, veidojas antivielas pret visām vīrusa struktūrām, lai gan neitralizējošo efektu saista tikai ar anti–Spike antivielām.
Dažādu ražotāju izstrādātajām antivielu noteikšanas metodēm ir atšķirīgi mērķa antigēni, robežvērtības, reaktivitātes līmenis un veiktspējas rādītāji. Svarīgi zināt, ar kādu metodi ir noteiktas antivielas, un jāseko ražotāja noteiktajai interpretācijai.
Lai vērtētu antivielu līmeni pēc vakcinācijas, jāveic anti–Spike antivielu kvantitatīvie testi. Pret nukleokapsīda proteīniem vērsto antivielu testi ir nosakāmi tikai ar Covid–19 slimojušiem cilvēkiem.
Vēl nav pasludināti kvantitatīvie sliekšņi, kas ļautu apstiprināt “drošas aizsardzības” antivielu koncentrāciju. Mērvienību un testēšanas metožu standartizācija iesākta nesen un aizvien turpinās.
Pētījuma projektam tika saņemts Paula Stradiņa Klīniskās universitātes slimnīcas Klīniskās izpētes ētikas komitejas apstiprinošs atzinums Nr. 290490-18L.
Foto: Freepik.com