Aknu ciroze ir gala stadija aknu fibrozei, kad morfoloģiski tiek nojaukta aknu arhitektonika un veidojas reģenerācijas mezgli. Cirozes pacienti ir pakļauti nopietnu, dzīvībai bīstamu komplikāciju riskam, tāpēc saīsinās viņu dzīvildze. Ciroze ir neatgriezeniska patoloģija, dekompensācijas gadījumā vienīgā efektīvā ārstēšanas iespēja ir aknu transplantācija.
Raksta mērķis ir atgādināt par aknu cirozes biežākajiem iemesliem, diagnostiku un ārstēšanas principiem. Patoģenētiskos mehānismus dažādu cirozes komplikāciju gadījumā un smalkākas ārstēšanas nianses katrā konkrētā cirozes gadījumā šoreiz neaplūkosim.
Diagnostika
Aknu ciroze sākuma stadijā ir morfoloģiska diagnoze, kad klīniski, bioķīmiski un ar papildu izmeklēšanas metodēm specifiskas izmaiņas nevēro. Šāda situācija var ilgt vairākus gadus, izteiktus veselības traucējumus cilvēks parasti nejūt līdz brīdim, kamēr attīstās nopietnas, dzīvībai bīstamas komplikācijas, piemēram, asiņošana no varikozi paplašinātām vēnām vai ascīts. Šajā brīdi diagnozi var noteikt pēc klīniskām, laboratoriskām un papildu izmeklējumu rezultātu pazīmēm.
Lai noteiktu diagnozi "aknu ciroze", pacients rūpīgi jāizmeklē.
Vispārējas sūdzības - nespēks, svara zudums, slikta apetīte.
Anamnēze par iespējamiem aknu slimības riska faktoriem (alkohola lietošana, cukura diabēts, medikamentu lietošana, hemotransfūzijas, ģimenes anamnēze, autoimūnās slimības u.c.)
Objektīvā izmeklēšana - hroniskas aknu slimību pazīmes: aknu zvaigznītes (skat. 1. attēlu)
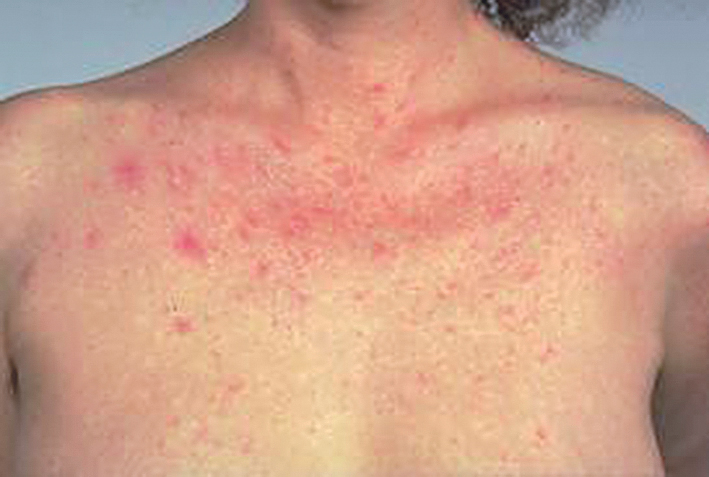

1. attēls
Aknu zvaigznītes
, palmāra eritēma (skat. 2. attēlu)
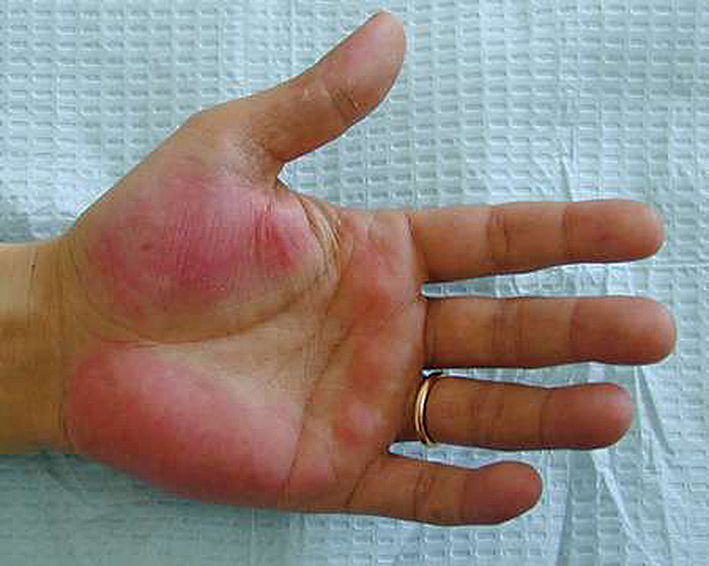

2. attēls
Palmāra eritēma
, nagu izmaiņas, Dipitrēna kontraktūra (skat. 3. attēlu)
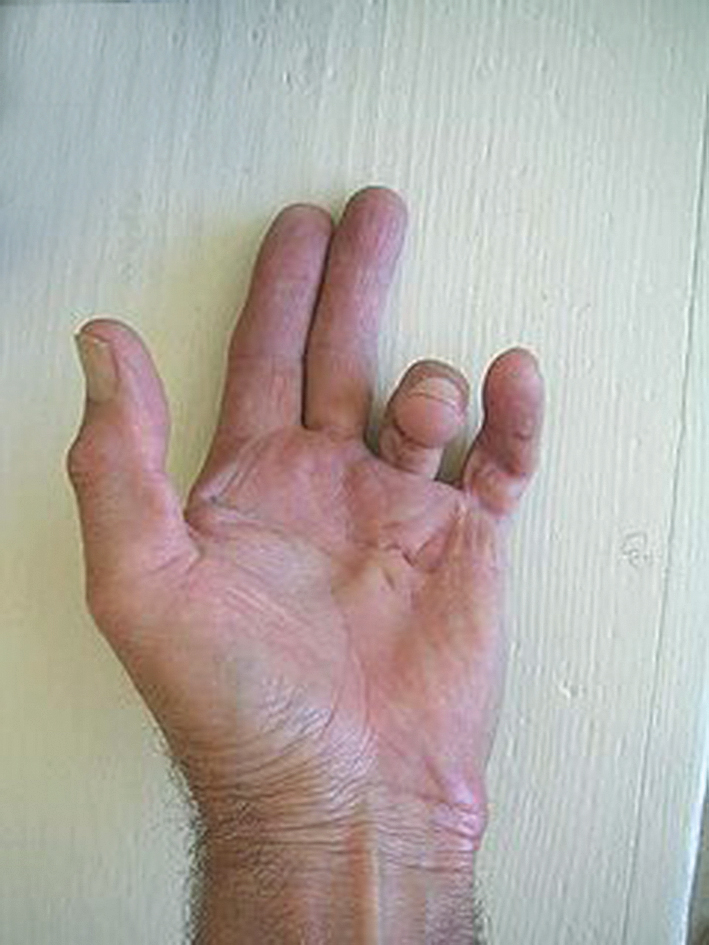

3. attēls
Dipitrēna kontraktūra
, ginekomastija (skat. 4. attēlu)
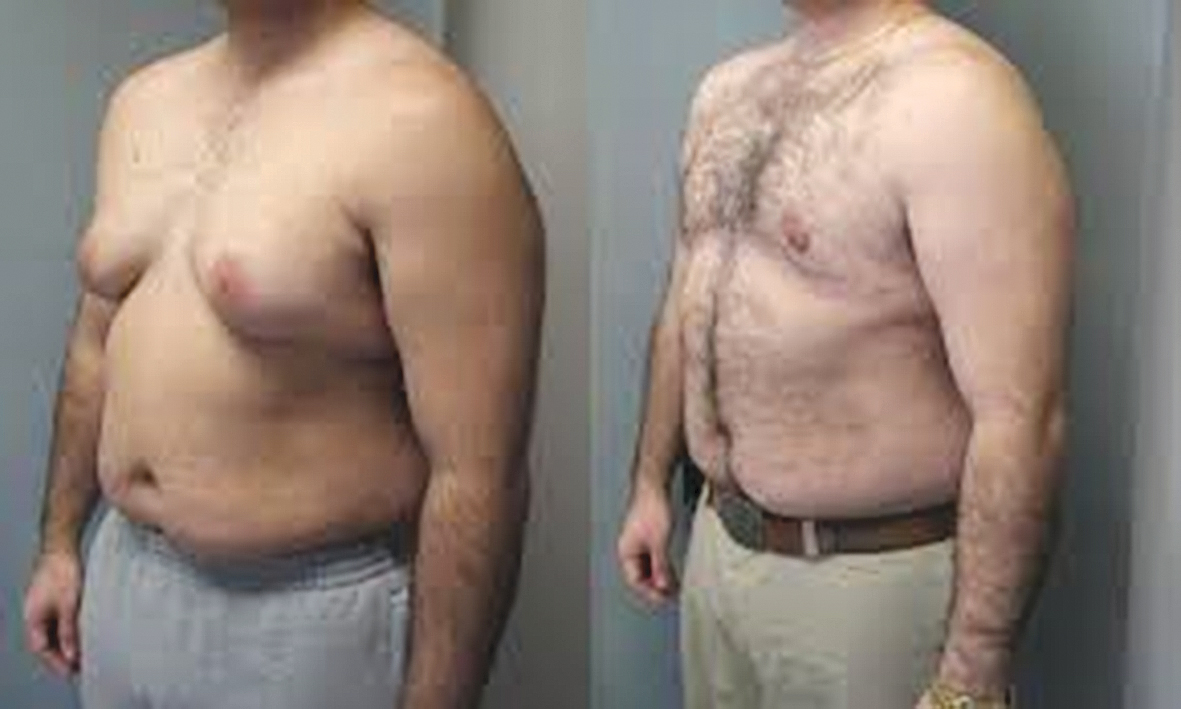

4. attēls
Ginekomastija
, hipogonādisms, hepato-megālija, splenomegālija, ascīts, paplašinātas vēdera priekšējās sienas vēnas - "medūzas galva" (skat. 5. attēlu)
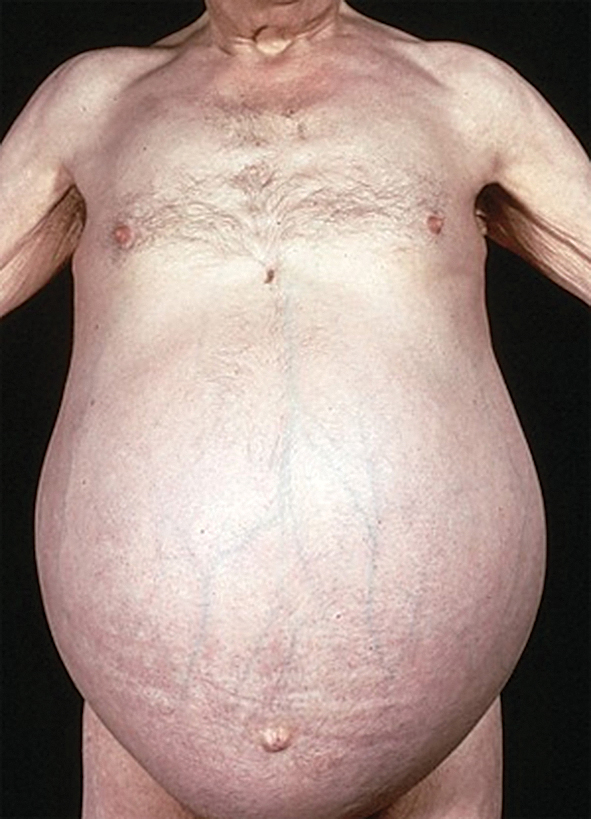

5. attēls
Ascīts, “medūzas galva”
, aknu smaka, dzelte, specifiska roku trīce (flapping tremor) (skat. 6. attēlu)
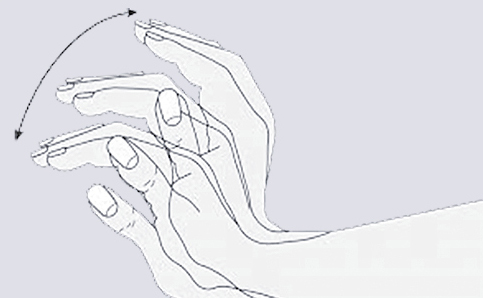

6. attēls
Flapping tremors
.
Laboratoriskā atrade
Laboratoriskā atrade izmainītu aknu funkcionālo testu (AFT) gadījumā: aminotransferāzes, sārmainā fosfatāze, gamma glutamiltranspeptidāze, pacients papildus jāizmeklē, lai noskaidrotu izmaiņu iemeslu. Tomēr šie testi neliecina par aknu funkcionālo stāvokli, funkciju labāk atspoguļo protrombīna indekss, olbaltumvielu frakcijas (albumīns) un bilirubīns. Tālāk aprakstītas raksturīgākās laboratoriskās izmaiņas aknu cirozes gadījumā.
- Aminotransferāzes - AlAT un AsAT aktivitāte parasti ir nedaudz palielināta, taču var būt arī normas robežās, parasti AsAT pārsniedz AlAT aktivitātes līmeni, bet alkohola hepatīta gadījumā AsAT/AlAT attiecība ir > 2.
- Sārmainā fosfatāze (SF) - līmenis nedaudz paaugstināts vai normas robežās, izteikti paaugstināts primāras biliāras cirozes un primāra sklerotizējoša holangīta gadījumā.
- Gamma glutamiltranspeptidāzes (GGT) aktivitāte parasti korelē ar SF un ir holestāzes rādītājs, tomēr izteikti palielināta GGT aktivitāte ir alkohola hepatīta gadījumā, kas saistīts ar mikrosomālo vai hepatocītu GGT atbrīvošanos alkohola ietekmē.
- Bilirubīns - kompensētas cirozes gadījumā tā koncentrācija ir normas robežās, taču dekompensācijas gadījumā līmenis paaugstinās, kas ir prognostiski slikts rādītājs.
- Albumīns tiek sintezēts tikai aknās, tāpēc liecina par aknu funkciju. Albumīna līmenis serumā parāda aknu cirozes dekompensācijas pakāpi. Tomēr jāatceras, ka hipoalbuminēmija raksturīga arī sirds mazspējas, nefrotiskā sindroma, enteropātijas un nepietiekama uztura gadījumā.
- Protrombīna laiks, protrombīna indekss, INR - šie rādītāji savstarpēji korelē. Tā kā recēšanas faktorus sintezē aknas, tad protrombīna laika pagarināšanās, protrombīna indeksa samazināšanās, INR pieaugums liecina par pavājinātu aknu sintētisko funkciju aknu cirozes gadījumā. Tomēr recēšanas faktoru sintēze samazinās arī akūtu hepatītu (bez cirozes) un hematoloģisku slimību gadījumā.
- Globulīni - to līmeņa paaugstināšanās aknu cirozes gadījumā saistāma ar baktēriju translokāciju un pastiprinātu imūnglobulīnu sintēzi. Izteikti paaugstināts IgG līmenis raksturīgs autoimūnam hepatītam, IgM - primārai biliārai cirozei.
- Nātrija līmenis - hiponātriēmija ir dekompensētas cirozes pazīme, pacientiem ar ascītu organisms nespēj izvadīt šķidrumu, pastiprināti sintezējas antidiurētiskais hormons.
- Anēmija - raksturīga cirozes pacientiem vairāku iemeslu dēļ: gastrointestināla asiņošana, folskābes deficīts, hipersplenisms, alkohola tieša toksiska iedarbība, kaulu smadzeņu darbības nomākums, hronisks iekaisums, hemolīze.
- Trombocitopēnijas iemesli: splenomegālija portālās hipertensijas gadījumā un hipersplenisms, pazemināts trombopoetīna līmenis.
- Leikopēnija, neitropēnija attīstās hipersplenisma dēļ.
- Aknu fibrozes marķieri serumā šobrīd joprojām ir izpētes stadijā ar mērķi tos izmantot aknu biopsijas vietā, tomēr līdz šim ikdienas praksē šos testus lieto reti, Latvijā praktiski nekad.
Radioloģiskās metodes
Radioloģiskās metodes izmanto galvenokārt cirozes komplikāciju noteikšanai - ascīta, hepatocelulāras karcinomas, portālās vēnas trombozes diagnostikai.
- Ultrasonoskopija (US) ir nekaitīga metode: pacientiem ar aknu cirozi redz maza izmēra aknas (labā daiva samazināta, bet kreisā un kaudālā - hipertrofētas), nelīdzenu virsmu, rupjgraudainu struktūru. Palielināta ehogenitāte var liecināt par taukaino hepatozi. Tomēr cirozes apstiprināšanai šī metode neder. Var izmantot komplikāciju diagnostikai - perēkļu izmaiņas aknās, portālās hipertensijas pazīmes - plata portālā vēna, kolaterāles, umbilikālās vēnas rekanalizācija, splenomegālija, ascīts, portālās vēnas tromboze.
- US apakšmetode ir aknu audu blīvuma vai cietības mērīšana ar speciālu tehniku (Fibroscan, EchoSense), lai noteiktu fibrozi, tomēr šī metode nav specifiska, turklāt aknu audu blīvums pieaug ne tikai fibrozes un cirozes gadījumā. Ikdienas praksē lieto reti, aknu biopsiju cirozes apstiprināšanai šī metode neaizvieto.
- Datortomogrāfija (DT) - var izmantot līdzīgi kā US, taču cirozes diagnozi apstiprināt ar DT nevar.
- Magnētiskā rezonanse (MR) - nedaudz jutīgāka metode, salīdzinot ar US vai DT, var izmantot, ja aizdomas par hemohromatozi, portālās vēnas trombozi, žultsceļu patoloģiju.
- Radionukleīdā izmeklēšana ar 99mTc sulfīdkoloīdu, ko pastiprināti uzkrāj retikuloendoteliālās sistēmas audi. Tomēr cirozes gadījumā šīs metodes specifiskums un jutība nav noskaidrota.
- Aknu biopsija - joprojām zelta standarts cirozes diagnozes apstiprināšanā. Audu paraugu izmeklēšanai iegūst pēc transplantācijas, izmeklējot izņemto aknu, vai klīniskajā praksē - perkutānas, transjugulāras, laparoskopiskas biopsijas laikā. Metodes jutība (80-100%) ir samērīga iegūtā parauga lielumam un morfologa pieredzei. Tomēr aknu morfoloģiskā izmeklēšana nav nepieciešama, ja klīniskā aina un izmeklējumu rezultāti nešaubīgi liecina par aknu cirozi. Tad diagnozi nosaka klīniski. Dažkārt biopsija nepieciešama, lai noteiktu cirozes iemeslu, piemēram, nealkohola steatohepatīts, autoimūns hepatīts, Vilsona slimība, hemohromatoze, alfa 1 antitripsīna deficīts.
Raksturīgākās izmaiņas, ko konstatē klīniskos, laboratoriskos un instrumentālos izmeklējumos pacientiem ar aknu cirozi, apkopotas 1. tabulā.
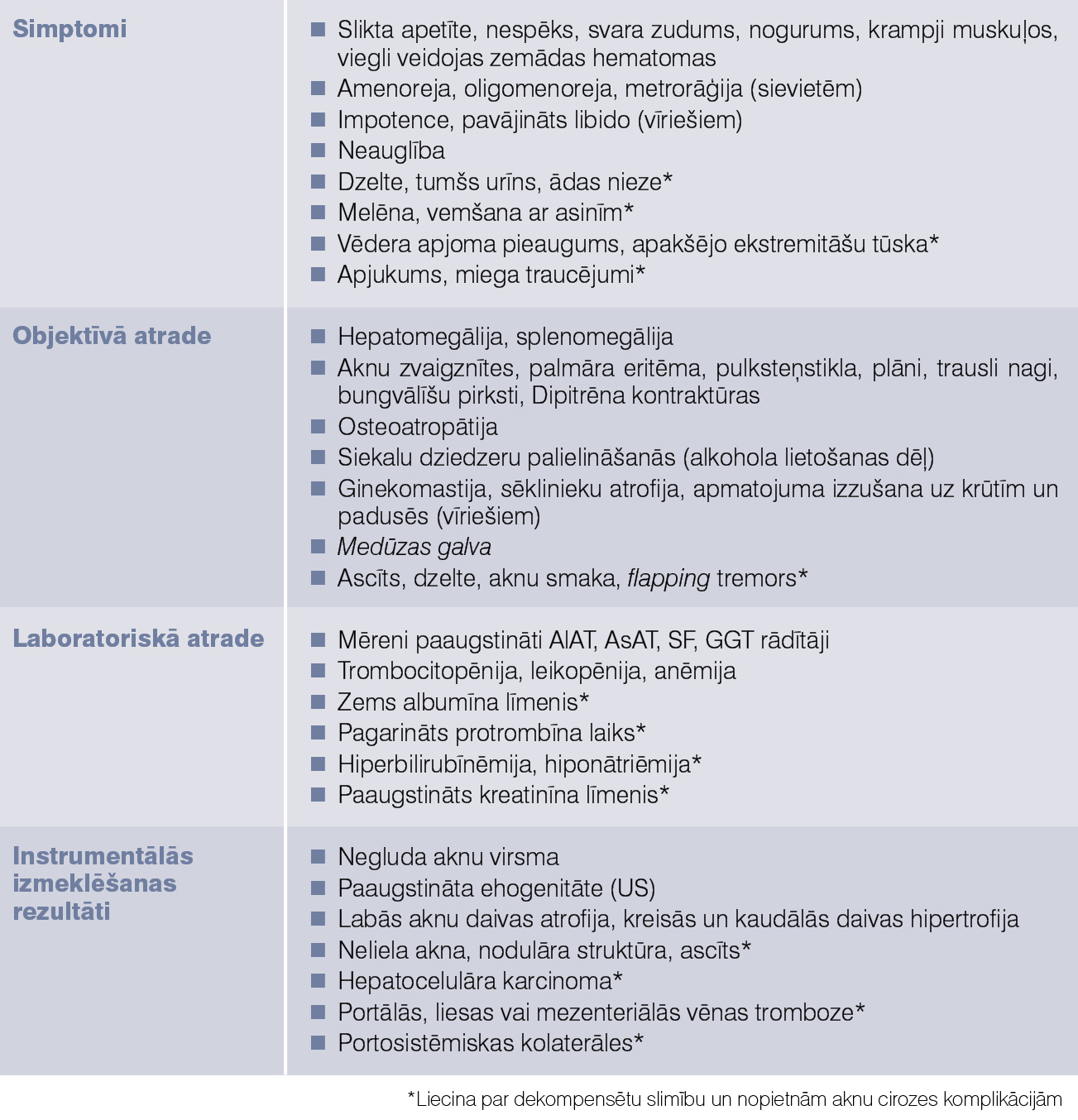

1. tabula
Aknu cirozes klīniskās izpausmes
Aknu cirozes iemesli
Divi biežākie aknu cirozes iemesli ir alkohola hepatīts un hronisks C vīrushepatīts; skat. 2. tabulu. Kriptogēnas (nezināma iemesla) cirozes pacientu skaits, uzlabojoties diagnostikas metodēm, samazinās. Šobrīd tas ir ap 10-15%. Biežākais kriptogēnas cirozes iemesls ir nediagnosticēts nealkohola steatohepatīts. Cirozes iemesla noteikšana ir svarīga, jo daudzu slimību gadījumā iespējama etioloģiska terapija arī jau cirozes stadijā, piemēram, hronisks B vīrushepatīts, autoimūns hepatīts, Vilsona slimība, hemohromatoze. Iedzimtu ģenētisko slimību gadījumā svarīga pacientu ģimenes locekļu izmeklēšana, lai laikus atklātu citus slimības gadījumus ģimenē.
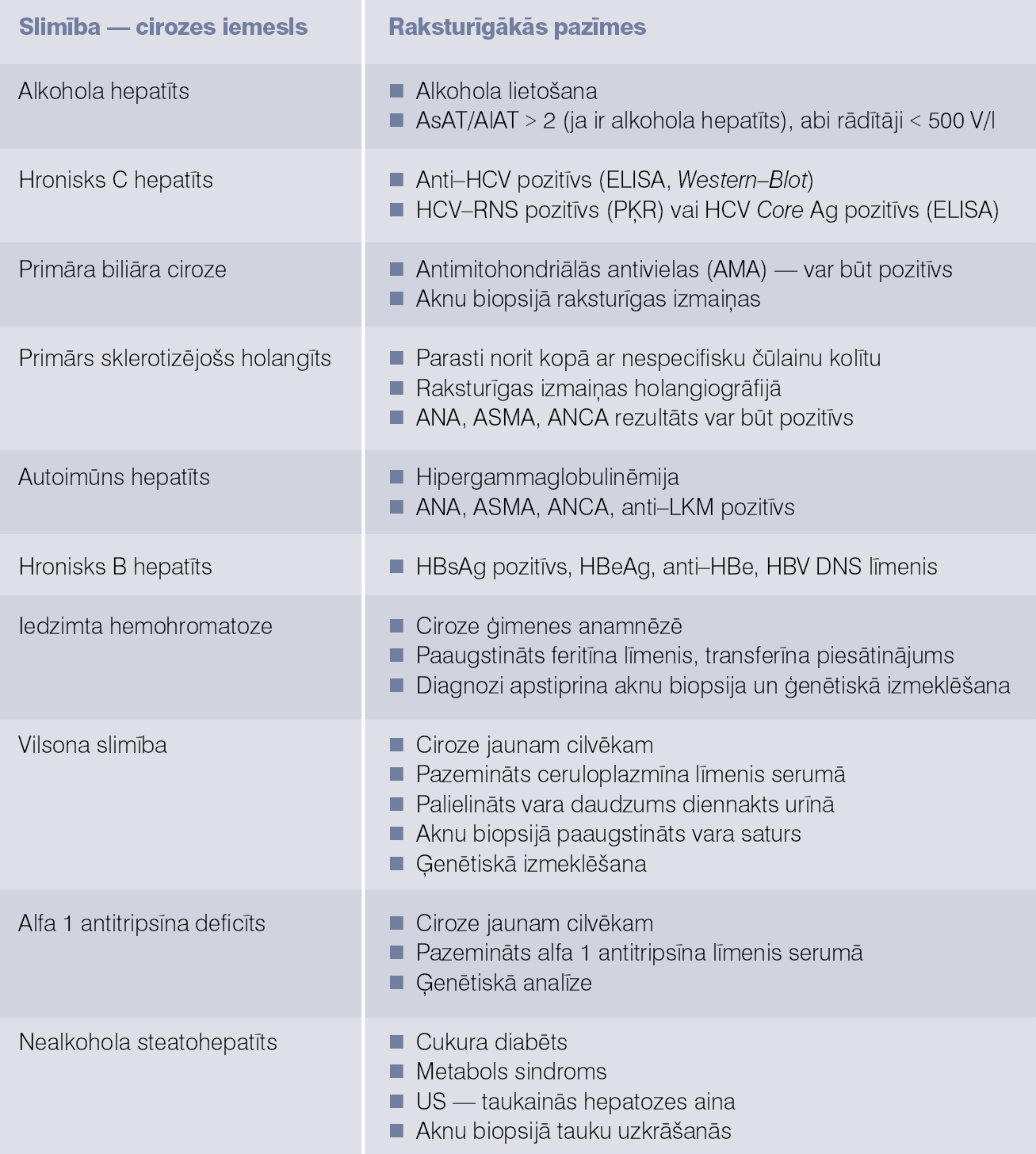

2. tabula
Aknu cirozes iemesli un pacienta novērtēšana
Aknu cirozes morfoloģiskā klasifikācija
- Mikronodulāra - mezgliņi līdz 3 mm diametrā, raksturīga alkohola, hemohromatozes, holestātisko slimību, aknu vēnas obstrukcijas izraisītas cirozes gadījumā.
- Makronodulāra - mezgliņi pēc izmēra dažādi, lielāki par 3 mm diametrā, parasti hronisku vīrushepatītu izraisītas cirozes gadījumā.
- Jaukta tipa.
Morfoloģiskā cirozes klasifikācija nav specifiska konkrētam etimoloģiskajam faktoram. Turklāt, cirozei progresējot, mikronodulārā forma var pāriet makronodulārā. Lai spriestu par etioloģisko faktoru, labāk izmantot seroloģiskos testus.
Aknu cirozes biežākās un nopietnākās komplikācijas
Dekompensējoties aknu cirozei, parādās nopietnas, dzīvībai bīstamas komplikācijas. Nereti šie stāvokļi prasa neatliekamu medicīnisko palīdzību un ārstēšanu intensīvās terapijas nodaļā. Tālāk īsumā aprakstītas iespējamās cirozes komplikācijas.
Ascīts
Ascīta gadījumā pacients sūdzas par vēdera apjoma pieaugumu un/vai samazinātu urīna daudzumu. Tomēr mūsu laikmetā, kad izplatīta vēdera aptaukošanās, tā var imitēt ascītu, tāpēc diagnozes precizēšanai nepieciešama rūpīga anamnēze un izmeklēšana. Šķidrums vēderā parasti uzkrājas relatīvi strauji ~ 2 nedēļās, parādās spiedošas, velkošas sāpes vēderā vai spiediena sajūta, elpas trūkums. Turpretī aptaukošanās parasti attīstās lēnāk - mēnešus vai gadus.
Spontāns bakteriāls peritonīts
Portālās hipertensijas gadījumā veidojas zarnu hipomotilitāte un lokāls imūndeficīts zarnās, šie faktori plus hipohlorhidrija (bieži - protonsūkņu inhibitoru lietošanas dēļ) veicina pastiprinātu baktēriju vairošanos zarnu lūmenā, pieaug zarnu permeabilitāte, baktērijas nonāk mezenteriālajos limfmezglos → baktēriju translokācija. Ascīta šķidrumā baktērijas var nonākt divos veidos: plīstot limfmezglam vai caur asinsriti (caur aknām, Glīsona kapsulu tās nonāk ascītā). Bakterēmijas gadījumā mikroorganismi nokļūst arī citās organisma vietās, izraisot urīnceļu infekciju, sepsi, celulītu, faringītu, dentālu infekciju.
Hepatorenāls sindroms (HRS)
HRS ir akūta nieru mazspēja, kas parasti pievienojas dekompensētai aknu slimībai - aknu cirozei, smagam alkohola hepatītam, audzējam vai jebkuras etioloģijas fulminantai aknu mazspējai. Hepatorenāla sindroma gadījumā ir samazināta nieru perfūzija, ko izraisa smaga aknu patoloģija. Aknu cirozes gadījumā portālā hipertensija izraisa viscerālo asinsvadu vazodilatāciju, hemodinamikas traucējumus un nieru darbības pavājināšanos, pastiprinās vazodilatatoru (no tiem nozīmīgākais ir slāpekļa oksīds) produkcija un aktivitāte. Slāpekļa oksīdu galvenokārt sintezē endotēlija šūnas. Dekompensējoties aknu slimībai, progresējoši pieaug sirds izsviede un samazinās perifērā pretestība, attīstās hipotensija un aktivējas renīna-angiotensīna un simpatiskā nervu sistēma. Nozīmīga ir arī baktēriju translokācija no zarnām uz mezenteriālajiem limfmezgliem. Samazinoties nieru perfūzijai, krītas arī glomerulu filtrācijas ātrums un nātrija ekskrēcija, pazeminās arteriālais asinsspiediens, lai gan ir izteikta nieru vazokonstrikcija. Daļēji šo stāvokli var koriģēt, izrakstot ornipresīnu vai vazopresīna analogus, kas paaugstina vidējo arteriālo spiedienu, samazina plazmas renīna aktivitāti un norepinefrīna koncentrāciju, pastiprina nieru asinsriti, glomerulu filtrāciju, nātrija un šķidruma izvadi.
Asiņošana no varikozi paplašinātām barības vada vēnām
Portālas hipertensijas (PHT) izraisīta gastrointestināla asiņošana ir dzīvībai potenciāli bīstama hroniskas aknu slimības komplikācija. Teorētiski jebkurš gastrointestinālā trakta bojājums (čūla, Mallory-Weiss sindroms, gastrīts, ezofagīts) PHT gadījumā var asiņot, tomēr visnopietnākā un dzīvībai bīstamākā asiņošana ir no varikozi paplašinātām barības vada vēnām.
Hepatopulmonāls sindroms
Hepatopulmonāls sindroms attīstās 4-47% pacientu ar šādu triādi:
- aknu slimība;
- paaugstināts alveolārais-arteriālais gradients;
- intrapulmonāla vaskulāra dilatācija.
Aknu hidrotorakss
Aknu hidrotorakss - izsvīdums pleiras telpā (parasti labajā pusē) pacientiem ar aknu cirozi, bez redzamas sirds patoloģijas. Izsvīdums pleiras telpā nonāk no vēdera dobuma ascīta caur defektīvām atverēm diafragmā.
Portopulmonāla hipertensija
Portopulmonāla hipertensija attīstās ~ 2% cirozes pacientu ar portālu hipertensiju, klīniski - nogurums, elpas trūkums, perifēras tūskas, sāpes krūtīs un/vai ģībonis. Papildus jāveic ehokardiogrāfija un jāmēra pulmonālais spiediens. Medikamentoza terapija šiem pacientiem ir mazefektīva, arī perioperatīvās mirstības riska pakāpe pēc transplantācijas ir augsta.
Kardiomiopātija
Pat 50% cirozes pacientu novēro arī sirds disfunkciju. Cirotiskas kardiomiopātijas gadījumā sirds izsviedes frakcija un kontraktilitāte miera stāvoklī ir normas robežās vai nedaudz palielināta, bet samazinās farmakoloģiska, fizioloģiska vai patoloģiska stresa apstākļos.
Alkohola lietotājiem var būt dilatācijas kardiomiopātija, hemohromatozes gadījumā dzelzs izgulsnējas sirds muskuļaudos un izraisa kardiomiopātiju.
Citas komplikācijas
- Aknu encefalopātija.
- Hepatocelulāra karcinoma.
- Portālās vēnas tromboze.
- Muskuļu krampji - to iemesls pilnībā nav skaidrs, varētu būt saistīts ar samazinātu efektīvās cirkulējošās plazmas daudzumu, otrs iemesls - elektrolītu disbalanss.
Prognoze
Cirozes pacientu prognoze ļoti atšķiras un ir atkarīga no pamatslimības, komplikācijām un ārstēšanas iespējām katrā konkrētā gadījumā. Aknu slimības iespējamai prognozei šobrīd izmanto vairākus modeļus.
Child-Turcotte-Pough modelis
Child-Turcotte-Pough (CTP) modeli veido pieci rādītāji: albumīns, INR, bilirubīns, ascīts, encefalopātija; skat. 3. tabulu.
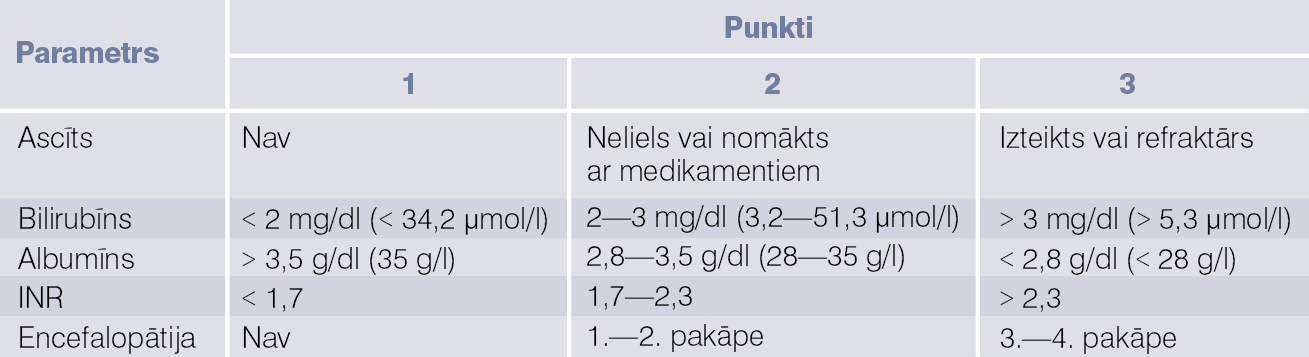

3. tabula
CTP klasifikācija
MELD modelis
MELD modeli (model of end stage liver disease) veido bilirubīna, kreatinīna un INR rādītāji; to izmanto, lai prognozētu dzīvildzi un lai noteiktu prioritāros pacientus aknu transplantācijai. Ir speciāla formula (atrodama dažādās tīmekļa vietnēs) un kalkulators, iegūtais skaitlis ir 6-40 punktu robežās. Pēc šā skaitļa prognozē trīs mēnešu dzīvildzi un viena gada dzīvildzi pēc aknu transplantācijas; skat. 4. tabulu.
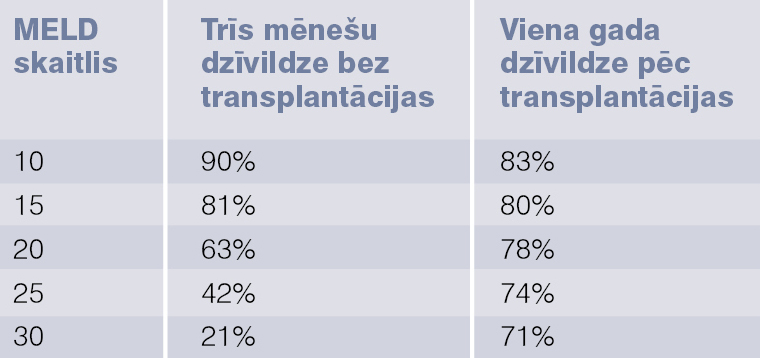

4. tabula
MELD skaitlis un prognoze
Ārstēšana
Cirozes ārstēšanas mērķi.
- Palēnināt slimības progresēšanu, pamatslimības ārstēšana.
- Ciroze pēc būtības ir neatgriezenisks process, tomēr, ārstējot dažas slimības, kas novedušas līdz cirozei, prognoze ir ļoti labvēlīga, ja ciroze nav galēji dekompensēta, piemēram, autoimūns hepatīts, Vilsona slimība, hroniskie vīrushepatīti. Alkohola cirozes gadījumā svarīgi atturēties no alkohola lietošanas.
- Citu kaitējošu faktoru novēršana.
- Pacientiem ar cirozi maksimāli jāizslēdz jebkura viela, kas varētu kaitēt aknām: alkohols, medikamenti, augu valsts preparāti un uztura bagātinātāji. Ja nav kontrindikāciju, rekomendē vakcināciju pret A un B hepatītu, pneimokoku infekciju un gripu.
- Komplikāciju ārstēšana un profilakse.
- Aknu transplantācijas indikāciju izvērtēšana un piemērotākā laika noteikšana.
- Nabas trūce - bieža problēma pacientiem ar aknu cirozi un ascītu. Rekomendācijas:
- trūces inkarcerācijas vai ruptūras gadījumā - neatliekama ķirurģiska iejaukšanās,
- simptomātiska trūce ar draudošām iesprūšanas pazīmēm - ķirurga konsultācija par ārstēšanos,
- asimptomātiska trūce - konservatīva ārstēšana: vēdera bandāžas, ascīta terapija.
Interesanti fakti par kafiju un aknu veselību
Kafija ir visvairāk lietotais dzēriens pasaulē. Jaunākie dati liecina, ka no kafijas lietošanas varētu būt ieguvumi arī veselībai. Ilggadējiem kafijas dzērējiem var būt mazāks 2. tipa cukura diabēta, simptomātiskas žultsakmeņu slimības, Parkinsona slimības, sirds slimību un insulta risks. Kafijas lietošana saistīta arī ar mazāku mirstību visu cēloņu dēļ. Tā kā hroniskas aknu slimības rada slogu sabiedrībai un kafijai ir pierādīti pozitīva iedarbība uz citām orgānu sistēmām, pētnieki nolēma pārbaudīt, vai ir saistība starp kafijas lietošanu un aknu funkciju rādītājiem.
Meta-analīzē iekļāva pētījumus, kas publicēti 1986.-2012. gadā, un analizēja saistību starp kafijas lietošanu un aknu slimībām.
Pētnieki secināja, ka kafijas lietošana saistīta ar retāku hronisku aknu slimību sastopamību. Divas tasītes kafijas dienā saistītas ar mazāku aknu fibrozes biežumu (OR = 0,33; 95% TI [], p = 0,015). Novērotā saistība saglabājās arī pēc samērošanas pēc vecuma, dzimuma, rases, aknu slimībām, ĶMI, alkohola lietošanas un C hepatīta vīrusinfekcijas klātbūtnes. Pētījumā, kur pacientus novēroja 19 gadus, secināts, ka pētījuma dalībniekiem, kas katru dienu izdzer vairāk nekā divas tasītes kafijas, par 50% retāk novēro hronisku aknu slimību nekā tiem, kas izdzer mazāk kā tasīti kafijas dienā. Turklāt kafijas lietotājiem ir mazāka varbūtība, ka attīstīsies ciroze. Divos pētījumos Itālijā secināts, ka kafijas lietošana aizkavē cirozes attīstību. Izredžu attiecība, ka attīstīsies ciroze, samazinās proporcionāli izdzertajam kafijas daudzumam (OR = 1 - kafijas nelietotājiem; OR = 0,47 - tiem, kas izdzer tasīti dienā; OR = 0,23 - 2 tasītes dienā; OR = 0,21 - 3 tasītes dienā; OR = 0,16 - vismaz 4 tasītes dienā). Desmit gadus ilga kohortas pētījuma rezultāti ASV apliecina, ka kafija var mazināt hospitalizācijas nepieciešamību un mirstību alkohola cirozes dēļ. Arī pētījumā Norvēģijā secināts, ka ir saistība starp kafijas lietošanu un mirstību no cirozes. Mirstības rādītāji bija zemāki tiem, kas izdzēra vismaz trīs tasītes kafijas, salīdzinot ar tiem, kas izdzēra divas vai mazāk tasītes dienā. Saistība saglabājās arī pēc samērošanas pēc vecuma, dzimuma, alkohola lietošanas un citiem kardiovaskulārajiem riska faktoriem.
Vairākos epidemioloģiskos pētījumos pierādīts, ka trīs un vairāk kafijas tasīšu izdzeršana dienā mazina hepatotoksicitātes smagumu un risku.
AVOTS: Saab S, Mallam D, Cox GA, Tong MY. Impact of Coffee on Liver Diseases. Liver International. 2014;34(4):495-504.
Komentē Dr. med. I. Tolmane:
"Pētījumu dati par kafijas labvēlīgo ietekmi uz veselību - īpaši uz aknu veselību - ir pārliecinoši. Kafija satur kofeīnu, metilksantīnu, to satur arī tēja un citi augi. No katras tasītes vidēji uzsūcas ap 85 mg šīs aktīvās vielas, lai gan tas atkarīgs no kafijas audzēšanas apstākļiem, pagatavošanas veida un tā, vai kafija ir maltā vai šķīstošā. Kofeīns uzsūcas no kuņģa un tievajām zarnām, metabolizējas aknās ar citohroma P450 palīdzību, kofeīna pusizvades laiks ir 4-6 stundas.
Kofeīns organismā saistās ar adenozīna receptoriem un nomāc zvaigžņveida šūnu aktivitāti un saistaudu augšanas faktora sintēzi aknās, tātad nomāc arī kolagēna sintēzi un izgulsnēšanos.
Kafija satur kahveolu un kafestolu, kas veicina holesterīna sintēzi, taču šīs vielas paliek uz kafijas filtriem, līdz ar to filtrētā kafija holesterīna vielmaiņu ietekmē maz. Šie efekti arī izskaidro labvēlīgo kafijas ietekmi uz aknu veselību. Protams, tas nenozīmē, ka var droši lietot daudz alkohola, uzdzert kafiju un veselības problēmu nebūs, tomēr, runājot ar pacientu par ierobežojumiem uzturā aknu slimības dēļ, kafija ir atļauta, pat trīs tasītes dienā."