Sāpīgas diabētiskas neiropātijas (SDN) pamatā ir neiropātisku sāpju komponents, kad pretsāpju farmakoterapija ārstiem bieži rada grūtības efektīvākā medikamenta izvēlē. Mūsdienās, meklējot atbilstīgu pretsāpju līdzekli, stingri jāņem vērā pierādījumi pētījumos, ievērojot personalizētas medicīnas paņēmienus.
Rakstā apkopojām Pasaules Sāpju institūta (World Institute of Pain, WIP) Dr. Andrea Nicol un līdzautoru (ASV) 2018. gada atzinumus, analizējot starptautiski citējamas publikācijas, lai sniegtu ieskatu, kas varētu palīdzēt efektīvāk ārstēt augstākminēto sāpju stāvokli.
WIP un Slimību kontroles un profilakses centri (Centers for Disease Control and Prevention, CDC) atzīst, ka šobrīd pasaulē ir opioīdu krīze, proti, hroniska sāpju stāvokļa ārstēšanā nepamatoti daudz lieto opioīdus, lai gan būtu jāizvēlas neopioīdi līdzekļi un nefarmakoloģiska terapija. [1]
Apskata mērķis un metodes
Apskata mērķis: izvērtēt neopioīdus medikamentus, ko mūsdienās, pamatojot ar pierādījumiem, lieto neiropātisku sāpju ārstēšanai sāpīgas diabētiskas neiropātijas gadījumā.
Apskata metodes: iekļaušanas kritēriji — pieaugušie (≥ 18 gadi) ar hroniskām sāpēm, kas ilgst ≥ 3 mēnešus, analizēta neopioīdu medikamentu efektivitāte, salīdzinot ar placebo vai citiem medikamentiem, apskatīti tikai perspektīvi, ne–nejaušināti, kontrolēti un nepārredzami pētījumi. Izslēgti pētījumi, kur nepārredzamības būtība netika konstatēta vai radīja šaubas. Pētījumu iznākumu pamato sāpju skalas, funkcionālais stāvoklis, dzīves kvalitāte.
Analizēti pētījumi tikai angļu valodā no datubāzēm Cochrane, PubMed un SCOPUS. Meklēšanas stratēģija apskatāma vietnē http.://links.lww.com/AA/B956, pētījumiem nebija laika limita (1. attēls).


Attēls
Pētījumu iznākums pēc sāpju skalu rādījumiem, funkcionālā stāvokļa, dzīves kvalitātes
Apskatītas neopioīdu medikamentu klases, ārstējot SDN:
- topiski (ne lokāli) un lokāli anestēzijas līdzekļi — kapsaicīns, meksiletīns, ketamīns, klonidīns;
- amīnu atpakaļuzsūkšanās inhibitori (AAUI) — duloksetīns, venlafaksīns, paroksetīns, fluoksetīns, imipramīns, disipramīns, amitriptilīns;
- membrānas stabilizatori — pregabalīns, gabapentīns, topiramāts, lamotrigīns, karbamazepīns, zonisamīds;
- jaukti amīnu atpakaļuzsūkšanās inhibitori/opioīdi (JAAUI–opioīdi) — tapentadols, tramadols;
- N–metil–D–aspartāta antagonisti (NMDA) — dekstrometorfāns, ketamīns;
- citi un/vai medikamentu kombinācijas — botulīna toksīns A, inhalējamie kanabinoīdi, sintētiskie kanabinoīdi, klonidīns.
Sāpīga diabētiska neiropātija
SDN izplatība starp neiropātijām ir 43 %. Lielāka sastopamība ir 2. tipa cukura diabēta pacientiem — 51 %, bet 1. tipa cukura diabēta pacientiem tikai 26 %. PVO dati liecina, ka potenciālais cukura diabēta pacientu skaits 2030. gadā būs 366 miljoni. [7]
SDN ārstēšana ir daudzfaktoru un iekļauj gan FDA apstiprinātas indikācijas, gan FDA neapstiprinātās indikācijās aprobēto ne–opioīdu pretsāpju terapiju. [8]
Efektīvākos medikamentus SDN sāpju mazināšanai pamato pierādījumi (1. tabula). Tā kā SDN farmakoterapijā lieto maksimālās (dažkārt pat ļoti lielas, vislielākās) medikamentu devas, svarīgi atcerēties un ņemt vērā medikamentu radītās blaknes (2. tabula).
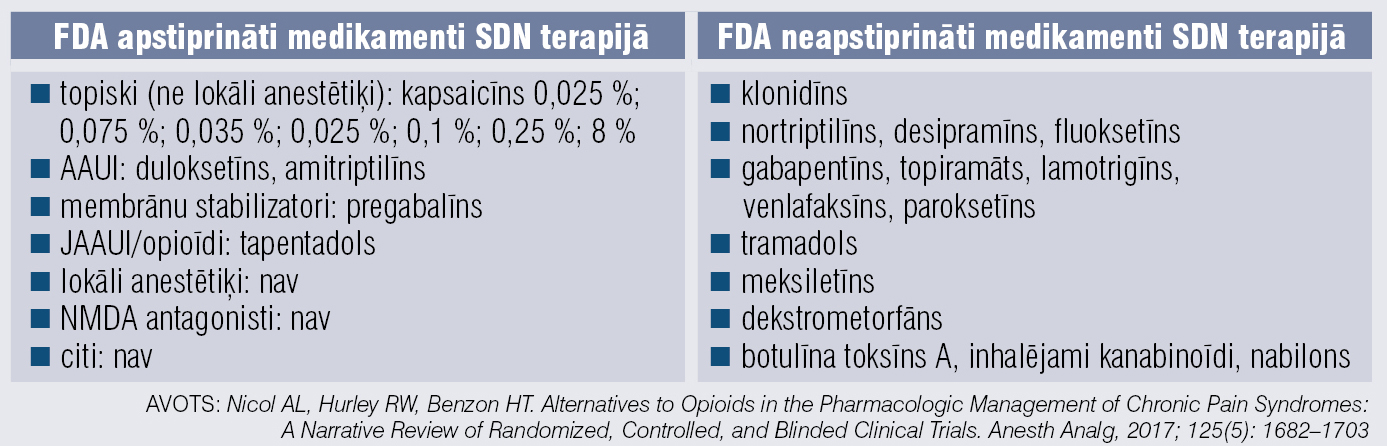

1. tabula
Efektīvākie medikamenti sāpīgas diabētiskas neiropātijas sāpju mazināšanai


2. tabula
Sāpīgas diabētiskas neiropātijas terapijā izmantojamo medikamentu blakusparādības
Membrānas stabilizatori
Pregabalīns
Medikaments iekļauts FDA apstiprinātās indikācijās. Sāpju intensitāte mazinās no 1,5—1,6 punktiem pēc sāpju intensitātes skalas ar devu 300 mg/dienā. [9] Visstiprākās iespējamās sāpes pēc pirmās medikamenta lietošanas nedēļas ievērojami mazinās 52 % pacientu (24 % placebo grupā).
NNT (number needed to treet) 3,6. NNT ir vidējais to pacientu skaits, kurus nepieciešams ārstēt, lai novērstu vēl vienu sliktu iznākumu (piemēram, pacientu skaits, kuri jāārstē, lai viens no viņiem gūtu labumu salīdzinājumā ar kontroli klīniskajā pētījumā). To definē kā absolūtu riska samazinājumu. Krietni uzlabojas dzīves kvalitāte un miegs. Sākuma deva 50—75 mg/dienā. Efektīvākā deva ir 300—600 mg/dienā. [10]
Gabapentīns
FDA neapstiprināta indikācija. Sāpju intensitāte samazinās četrās nedēļās, ko pierāda daudzi ne–nejaušināti kontrolēti pētījumi. [14] Ievērojami uzlabojas dzīves kvalitāte, miegs. Sākuma deva 100—300 mg/dienā. Minimālā efektīvā deva 1800—2400 mg/dienā. Minimāli efektīvā deva dažreiz var sasniegt medikamenta maksimālo devu vai pat ļoti lielas medikamenta devas. Jāņem vērā medikamenta radītās blaknes. Maksimālā pieļaujamā deva 3600 mg/dienā. [17]
Topiromāts
FDA neapstiprināts. Šaubīga efektivitāte — divos pētījumos efektīvs un divos pētījumos neefektīvs. Pozitīvos efektivitātes pētījumos pierādīts sāpju intensitātes samazinājums 8. nedēļā — uzlabojas dzīves kvalitāte un miegs.
Pierādīta svara samazināšanās visos pētījumos. Sākuma deva 25 mg/dienā. Minimālā efektīvā deva 100 mg/dienā. Maksimālā pieļaujamā deva 400 mg/dienā. [18; 19]
Lamotrigīns
FDA neapstiprināts. Minimāli efektīvs divos pētījumos, neefektīvs vienā pētījumā. [56] Pierādīta tikai sāpju intensitātes mazināšanās, citādi — bez efekta. Sāpju samazināšanās sešās nedēļās. Sākuma deva 25 mg/dienā.
Minimālā efektīvā deva vienāda ar maksimāli pieļaujamo devu 400—600 mg/dienā, sadalot divās daļās. [20; 21]
Karbamazepīns/okskarbazepīns
FDA neapstiprināta kombinācija. Neefektīva divos pētījumos [23; 24], efektīva vienā pētījumā. [22] Sāpju intensitātes samazināšanās divās nedēļās. Sākuma deva 200 mg/dienā. Minimālā efektīvā deva 1200—1800 mg/dienā. [22]
Zonisamīds
FDA neapstiprināts. Sāpju intensitāte samazinās tikai vienā nelielā pētījumā. [25] Pētījums nesasniedz kritēriju “ievērojams samazinājums”. Autoru atzinums: sāpju intensitāte samazinās par 2 punktiem pēc Sāpju Intensitātes skalas (Pain Intensity Score; PIS).
Amīnu atpakaļuzsūkšanās inhibitori
Duloksetīns
FDA apstiprināts SDN terapijai. Sāpju intensitātes samazinājums pierādīts vienā nedēļā. [26; 27] Ievērojami uzlabo dzīves kvalitāti, miegu un garastāvokli. Septiņi pozitīvi pētījumi [26; 27; 29] un viens negatīvs pētījums. [28]
Sākuma deva 30 mg/dienā. Minimālā efektīvā deva 60 mg/dienā. [33]
Venlafaksīns
FDA neapstiprināta indikācija. Sāpju intensitāte samazinās pēc 2—6 nedēļām. NNT 4,5. Sākuma deva 37,5 mg/dienā. Minimālā efektīvā deva 150—225 mg/dienā. [34]
Selektīvie serotonīna atpakaļsaistes inhibitori
Selektīvie serotonīna atpakaļsaistes inhibitori (SSAI) ir FDA neapstiprināta medikamentozās terapijas iespēja SDN gadījumā. Nepietiekams skaits pētījumu. Paroksetīns, [36] bet ne fluoksetīns [37] samazina sāpju intensitāti. Uzlabo miegu un samazina nakts sāpes. Sāpju samazinājums jau 1.—5. dienā. Minimālā efektīvā deva 40—50 mg/dienā. [38]
Tricikliskie antidepresanti
Imipramīna (FDA neapstiprināta indikācija), [41], disipramīna (FDA neapstiprināta indikācija), [39; 40] amiptriptilīna (FDA apstiprināta indikācija) [39] inducēts sāpju intensitātes samazinājums sasniegts 3.—5. nedēļā.
Sāpes atjaunojas divas nedēļas pēc medikācijas atcelšanas. Sāpju mazināšanās nav atkarīga no depresijas klātbūtnes. Nav efekta uz garastāvokli, lietojot disipramīnu. Uzlabojas miega kvalitāte. Minimālā efektīvā deva 90—150 mg/dienā. [42]
Lokālie un topiskie (ne lokālie) anestētiķi
Kapsaicīns
FDA apstiprināta indikācija. Ne–nejaušinātos kontrolētos pētījumos topiski lietojams kapsaicīns mazā devā (< 0,075 %) pierāda efektivitāti, samazinot sāpju intensitāti, uzlabojot miegu un dzīves kvalitāti. [45]
Sāpju samazinājums sasniegts astoņās nedēļās. Jālieto 4 ×/dienā. [45] Ne–nejaušinātos kontrolētos pētījumos kapsaicīna 0,025 % ļoti mazās devas efektivitāti nepierādīja, salīdzinot ar placebo. [48] Nav pētījumu par 8 % kapsaicīna uzklāšanu lielās devās SDN gadījumā.
Meksiletīns
FDA neapstiprināta indikācija. Efektivitāte sāpju samazināšanā pierādīta vienā ne–nejaušinātā kontrolētā pētījumā, [49] bet divos pētījumos nav atšķirību iepretī placebo lietojumam. [50; 51]
Pētījumu ierobežojumi — mazas pētījumu grupas. Vienā pētījumā pierādīts uzlabojums nakts sāpju remdēšanā un miega kvalitātē. [49] Nepieciešamas lielas medikamentu devas — 675 mg dienā. Izteiktas blaknes — diareja un slikta dūša. [52]
NMDA antagonisti
Dekstrometorfāns un topiski lietojamie ketamīni nav apstiprināti no FDA puses.
Dekstrometorfāna efektivitāte sāpju intensitātes samazinājumā pierādīta divos pētījumos. [5; 6] Sāpju samazināšanās konstatēta četrās nedēļās. Efektivitātes sasniegšanai nepieciešamas ļoti lielas medikamenta devas. Sākuma deva 30 mg/dienā. Maksimāli pieļaujamā deva 90 mg/dienā. Minimālā efektīvā deva 250—450 mg/dienā. [5; 6] Pētījumos pēc 10 % ketamīna topiskas lietošanas sāpju intensitātes samazinājuma nav. [4; 53]
Jaukti amīnu atpakaļuzsūkšanās inhibitori/opioīdi
Tapentadols
FDA apstiprināts. Vidēji stiprām un stiprām sāpēm. Efektīvs, samazinot sāpju intensitāti. Sāpju samazinājums parasti 2—3 nedēļās. Vidējā efektīvā atsāpinošā deva > 100 mg dienā. [54; 55]
Tramadols
FDA neapstiprināts. Sāpju mazināšanās efektivitāte pierādīta vienā pētījumā. Uzlabo sociālo un fizisko funkcionēšanu. Sākuma deva 50—150 mg/dienā Vidējā efektīvā atsāpinošā deva 200 mg/dienā. Maksimālā pieļaujamā deva 400 mg/dienā. [56]
Cita farmakoterapija
Botulīna toksīns A
Intradermālas botulīna toksīna A injekcijas samazina sāpju intensitāti, uzlabo miega kvalitāti un dzīves kvalitāti. Sākuma deva 50—200 vienības/dienā. Sāpju samazinājums sasniegts vienā nedēļā. [57; 58]
Inhalējamie kanabinoīdi
Tetrahidrokanabinols (THC 1 %, 4 %, 7 %) samazina spontānas sāpes. No devas īsās darbības atkarīgs medikamenta lietošanas biežums.
Konstatētas negatīvas kognitīvas blaknes, lietojot lielas THC 7 % devas, un pretrunīgi medicīniskie/juridiskie lietošanas aspekti. Nepieciešamas lielākas pacientu grupas un ilgtermiņa novērojumi. [59]
Sintētiskie kanabinoīdi
Nabilons 1—4 mg efektīvāks nekā placebo, mazinot sāpju intensitāti un uzlabojot miega kvalitāti. Nav datu par minimālo efektīvāko devu.
Negatīvas kognitīvas blaknes un pretrunīgi medicīniskie/juridiskie lietošanas aspekti. Nepieciešamas lielākas pacientu grupas un ilgtermiņa novērojumi. [60]
Topikālais klonidīna gels 0,1 %
Kopējā dienas deva 3,9 mg/dienā. Lokāls lietojums 3 ×/dienā samazina SDN sāpes, salīdzinot ar placebo. [61]
Kombinētā terapija
Nortriptilīna/gabapentīna un morfija (pētīts gabapentīns) kombinācija ir efektīvāka nekā monoterapija. Samazina sāpju intensitāti, uzlabo miegu, noskaņojumu un dzīves kvalitāti. Novērots mazāk blakņu. [2; 3]