Ģimenes hiperholesterinēmija (ĢH) ir biežākā autosomāli dominantā ģenētiskā slimība ar agrīnu letālu iznākumu pieauguša cilvēka vecumā. To raksturo augsts kopējā holesterīna (KH) un zema blīvuma lipoproteīnu holesterīna (ZBLH) līmenis asinīs. Laikus neatpazīta un neārstēta ĢH veicina agrīnu aterosklerozes attīstību (prevalējoši koronārajās artērijās) un ievērojami palielina kardiovaskulāro notikumu risku.
Praktizējoša ārsta skatījumā būtisks ir fakts, ka ĢH gadījumā sakarā ar ilgtermiņa ZBLH akumulāciju asinsritē iespējama agrīna asimptomātiska aterosklerozes attīstība pat bez kombinācijas ar citiem kardiovaskulārajiem riska faktoriem (tradicionāli: smēķēšana, arteriālā hipertensija, cukura diabēts), savukārt, asimptomātiskai aterosklerozei kļūstot simptomātiskai, nav izslēgta iespēja pirmajai izpausmei būt akūtam koronāram sindromam.
Ģimenes hiperholesterinēmiju nosaka mutācija kādā no gēniem, kas kodē zema blīvuma lipoproteīnu klīrensu, lai gan ne visiem pacientiem ar feno-tipisku ĢH atrodamas zināmas mutācijas. No klīniskā viedokļa būtiski ir izšķirt homozigotu (mutācija abās gēna alēlēs) un heterozigotu (mutācija vienā no alēlēm). Atšķirībā no homozigotas ĢH, kas sastopama reti un kur spilgta klīnika sagaidāma jau agrīnā vecumā, izaicinājums ikdienas klīniskajā praksē joprojām ir savlaicīga heterozigotas ĢH atklāšana un attiecīga primārā profilakse. [1; 2] Latvijā kopš 2015. gada darbojas Latvijas Ģimenes hiperholesterinēmijas reģistrs (LĢHR), ir speciālistu konsultatīvais tālrunis (1. attēls).


1. attēls
Speciālistu konsultatīvais tālrunis
Izplatība un apzināšana
ĢH savlaicīga atpazīšana nav tikai Latvijas vai Austrumeiropas problēma, šī slimība šobrīd uzskatāma par nepietiekami diagnosticētu lielākajā daļā pasaules valstu. Lai iegūtu un apkopotu datus par reālo ĢH izplatību, diagnostikas metodēm un terapijas iespējām, Eiropas Aterosklerozes biedrība izvirzījusi iniciatīvu — Ģimenes hiperholesterinēmijas pētījumu sadarbības tīklu (Familial Hypercholesterolemia Studies Collaboration — FHSC).
2018. gadā FHSC publicēja ziņojumu par aktuālo situāciju 63 pasaules valstīs, no tām 35 Eiropas valstīs, arī Latvijā. Dati par heterozigotas ĢH izplatību ne tikai atsevišķos reģionos ir pieejami daļā Eiropas valstu, piemēram, Dānijā tās sastopamība tiek uzskatīta 1 : 233, Somijā 1 : 500, Vācijā 1 : 278—295, Nīderlandē 1 : 200—250, Norvēģijā 1 : 300. Šo datu pieejamību par valsti kopumā nodrošina nacionālo reģistru uzturēšana. Attiecībā uz atklāto ĢH pacientu proporciju potenciāli sagaidāmo vidū līderpozīcija pieder Nīderlandei ar atklātiem 71 % ĢH pacientu, bet jāpiebilst, ka šie ir dati par pirmreizējiem ĢH ģenētiskās diagnozes konstatēšanas faktiem 1990.—2014. gadā; nav centralizētu reģistra datu par šo pacientu aprūpi dinamikā. No valstiskā viedokļa būtiski ir uzturēt vienotu reģistru, kur pēc slimības pirmreizējas konstatēšanas perspektīvi tiek apkopota informācija par klīniskajiem notikumiem, saņemto valsts kompensēto terapiju, tās efektu un blaknēm. [3]
Latvijā kopš 2015. gada LĢHR darbības ietvaros ar aizdomām par ĢH konsultēti un reģistrā iekļauti 567 pacienti, no kuriem 245 gadījumos konstatēta klīniska ĢH (par diagnostikas principiem — nākamajā sadaļā), visiem pacientiem klātienē sniegta padziļināta informācija par diagnozi un ar to saistīto iespējamo profilaksi, kaskādes (jeb 1. pakāpes radinieku) sijājošās diagnostikas nepieciešamību, sniegtas rekomendācijas turpmākajai taktikai, nepieciešamības gadījumā sākta vai koriģēta hipolipidemizējošā terapija un nozīmēti papildu izmeklējumi, piemēram, asimptomātiskas aterosklerozes pierādīšanai, kas būtiski ietekmē riska kategoriju un attiecīgi arī terapiju. Pateicoties pacientu un citu viņus aprūpējošo kolēģu (ģimenes ārstu, citu speciālistu) līdzestībai un iesaistei, reģistrā perspektīvi tiek iegūta un apkopota informācija par pacientu tālākās aprūpes rezultātiem. [4]
Patoģenēze
Slimības attīstību nosaka defekts kādā no gēniem, kas atbild par to proteīnu sintēzi, kas nodrošina ZBLH atpakaļuzņemšanu hepatocītos. Normālu ZBLH katabolismu nosaka spēja ZBLH receptoram (ZBLH–R) hepatocīta virsmā piesaistīt ZBLH molekulu, saistoties pie ApoB–100 virsmas proteīna. Sekojoši receptors savienojumā ar piesaistīto ZBLH no šūnas virsmas tiek transportēts uz endosomu, kur ZBLH receptors tiek atdalīts, lai tiktu transportēts atpakaļ uz šūnas virmu. Šā procesa regulācijā nozīme ir vēl diviem proteīniem: ZBLH receptora adaptorproteīnam–1 (ietekmē šūnas virsmā ekspresētā ZBLH receptora funkciju) un proteīnam PCSK9, kas, piesaistoties ZBLH receptoram, pēc ZBLH molekulas atdalīšanas novirza ZBLH receptoru noārdīšanai, nepieļaujot tā atgriešanos šūnas virsmā (2. attēls).
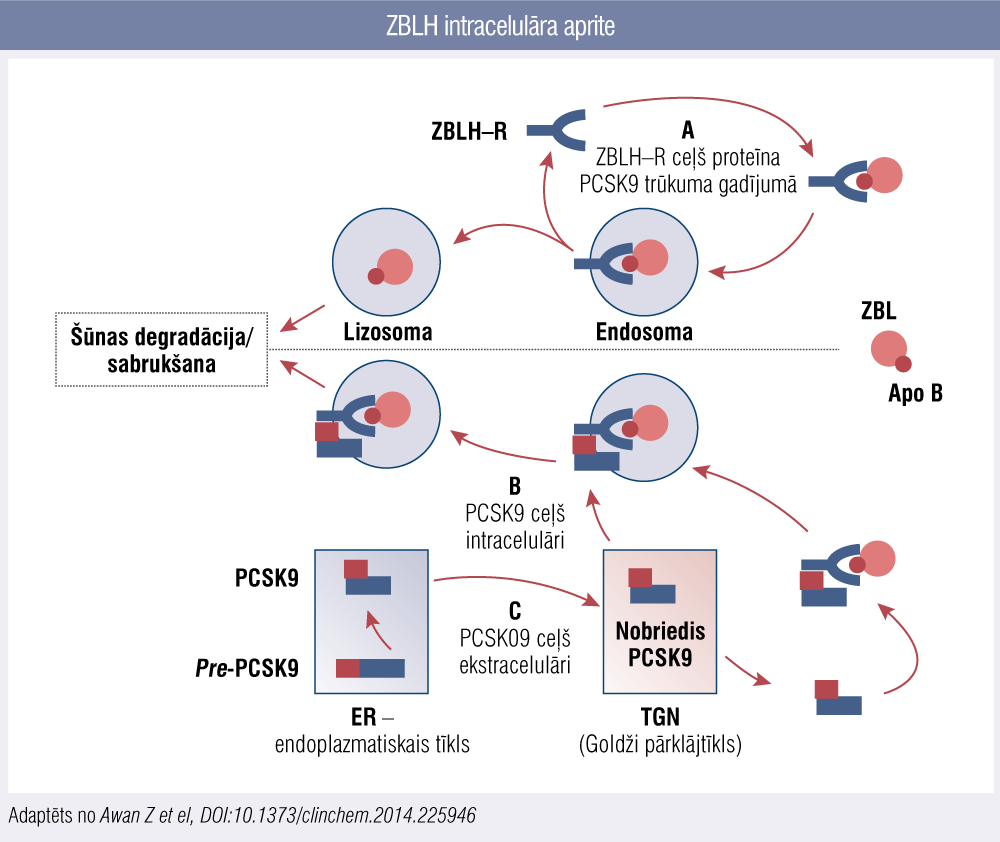

2. attēls
ZBLH intracelulāra aprite
Lielākajā daļā gadījumu ĢH izraisa mutācija tieši ZBLH receptora kodējošajā gēnā (aprakstīts vairāk nekā 1200 mutāciju variantu) — virs 90 % no ģenētiski apstiprinātas ĢH gadījumiem. Savukārt ApoB–100 kodējošā gēna mutācijas sastopama ~5 % gadījumu, vēl retāk (ap 1 %) — mutācijas PCSK9 (proproteīna konvertāzes subtilizīna/keksīna 9. tips) kodējošajā gēnā. Šo trīs gēnu mutācijas izraisīta ĢH tiek pārmantota autosomāli dominantā ceļā. Ļoti retos gadījumos tiek diagnosticēta mutācija ZBLH–R adaptorproteīnu–1 kodējošajā gēnā, tā tiek pārmantota autosomāli recesīvā ceļā, tātad fenotipiska izpausme ir sagaidāma homozigotiem. [1] Neatkarīgi no molekulārā pamatmehānisma ĢH būtība ir pārmēru lielas koncentrācijas ZBLH akumulācija asinsritē mūža garumā, kas pašplūsmā, bez korekcijas pieaug ar katru dzīves gadu. Lai gan ateroskleroze iespējama jebkurā asinsvadu baseinā, primāri un agresīvāk aterosklerotiskā slimība norit tieši koronārajās artērijās. Būtiski apzināties, ka ZBLH nav uzskatāms tikai par vienu no vairākiem kardiovaskulārā riska faktoriem (kā ilgstoši pieņemts uzskatīt), kur varētu diskutēt par katra konkrētā riska faktora nozīmīgumu kombinācijā ar citiem. 2017. gada Eiropas Aterosklerozes biedrības ekspertu slēdzienā, kas publicēts pēc vairāk nekā 200 pētījumu meta–analīzēm, ietverot virs 20 miljoniem pacientgadu un virs 150 000 kardiovaskulāro notikumu, konstatēta cēloņsakarība starp ZBLH līmeni un aterosklerotisku slimību, tādējādi definējot ZBLH kā aterosklerozes izraisītāju. [5]
Attīstība un slimības gaita
Aterosklerozes attīstības agrīnums un atero-sklerotiskās slimības agresivitāte ĢH pacientu vidū ļoti variē, un iemeslu tam ir daudz. Arī LĢHR ir gan 28 gadus vecs pacients ar asimptomātisku koronāru sirds slimību (koronāro artēriju stenozes līdz 75 %), gan 86 gadus veca paciente (reģistrā iekļaušanas brīdī ZBLH dokumentēts 9,3 mmol/l) ar smagu trīs artēriju slimību, kurai koronāra rakstura klīnika attīstījusies tikai pēdējos desmit gados.
Viens no galvenajiem faktoriem (bet ne izšķirīgais) ir konkrētā ZBLH koncentrācija, kam ilgtermiņā (būtībā visu pacienta mūžu) ir bijis pakļauts asinsvadu endotēlijs. ZBLH koncentrācija atkarīga ne tikai no paša ģenētiski noteiktā ZBLH aprites defekta per se, bet zināmā mērā arī no konkrētā indivīda dzīvesveida un ēšanas režīma. Lai gan pamatā ĢH raksturīgi augsti ZBLH rādītāji, ko neizdodas koriģēt ar dzīvesveidu, tomēr klīniskajā praksē sastopamas arī situācijas, kad ZBLH rādītāji, pateicoties optimālam dzīvesveidam, ir zemāki, nekā sagaidāms potenciālam ĢH pacientam, tādējādi radot risku hipodiagnostikai.
Pašsaprotams, ka agrīnāka un agresīvāka aterosklerozes gaita sagaidāma ĢH pacientiem kombinācijā ar tādiem riska faktoriem kā smēķēšana, arteriālā hipertensija, cukura diabēts. Viens no faktoriem, kas varētu izskaidrot situāciju, kāpēc diviem dažādiem ĢH pacientiem ar līdzvērtīgu ZBLH ilgtermiņa koncentrāciju un līdzvērtīgu citu riska faktoru statusu atšķiras aterosklerozes agrīnuma un smaguma pakāpe, ir lipoproteīna (a) jeb Lp(a) koncentrācija asinīs. Lp(a) ir asinsritē cirkulējoša molekula, kas sastāv no ZBLH un papildu specifiska virsmas proteīna (apolipoproteīna (a)), kas pēc struktūras līdzvērtīgs plazminogēnam — tātad tam ir protrombotiskas un antifibrinolītiskas īpašības, kas jau notiekošu aterosklerozes progresu var padarīt ievērojami agresīvāku.
Eiropas Kardiologu biedrības vadlīnijas dislipidēmiju korekcijai kā lietderīgu iesaka šā rādītāja noteikšanu tikai specifiskām pacientu grupām ar zināmu lielu risku, tātad arī ĢH pacientiem. Šo rādītāju nosaka E. Gulbja laboratorija, kā normu norādot < 30 mg/dl, taču par nozīmīgi paaugstinātu pēc Eiropas Aterosklerozes biedrības rekomendācijām tas uzskatāms, ja sasniedz > 50 mg/dl.
Lp(a) noteikšanai ĢH pacientam klīniskajā praksē papildu pienesums ir riska izvērtēšanā un attiecīgi terapijas intensitātes izvēlē — ja ĢH pacientam papildus augstajai ZBLH koncentrācijai cirkulācijā atrodas vēl cita aterogēna un trombogēna substance, tad prognozējama agrīnāka akūta notikuma attīstība nekā ĢH pacientam ar normālu Lp(a) līmeni. ĢH pacientiem ikdienas standarta terapija (statīni, ezetimibs) Lp(a) līmeni neietekmē un netiek rekomendēts to noteikt atkārtoti, bet, zinot šā riska faktora klātbūtni, ir mērķtiecīgi koriģēt ZBLH līmeni agresīvāk un noteikt zemākus tā mērķus, nekā izrietētu tikai no dokumentētas aterosklerozes un/vai ZBLH rādītājiem, kā arī iespējami maksimāli mazināt citus modificējamos riska faktorus. [5; 6]
Diagnostika
ĢH diagnozes noteikšanā izmantojamas divas metodes: klīniskie kritēriji un ģenētiskais diagnozes apstiprinājums, taču, lai katrā konkrētā gadījumā izdarītu pareizos secinājumus, kas ļautu izvēlēties optimālu taktiku konkrētajam pacientam, jāapzinās, ka situācija ir krietni sarežģītāka par “ir konstatēta mutācija — ir ĢH, nav konstatēta — tātad aizdomas neapstiprinās” vai “veiksim ģenētisko izmeklēšanu un uzzināsim, vai pacientam ir ĢH”.
Darbā ar potenciālu ĢH pacientu ļoti būtisks ir fakts, ka diagnozes noteikšanā ikdienas klīniskajā praksē lielā daļā gadījumu izšķirīga ir nevis pierādīta kauzālā mutācija, bet tieši klīniskie diagnostikas kritēriji. Tas izriet ne tikai no ģenētiskās izmeklēšanas (ne)pieejamības, bet no fakta, ka pētījumos pierādīts — pat 40 % pacientu, kas atbilst klīniskajiem ĢH kritērijiem, netiek konstatēta ĢH izraisoša mutācija nevienā no iepriekš aprakstītajiem četriem gēniem. Eksperti to skaidro ar iespējamību, ka procesā iesaistīti vēl citi līdz šim nezināmi gēni, kā arī ar varbūtību, ka ĢH daļā gadījumu var būt poligēna. [1]
Kad aizdomāties par diagnozi?
Pirms sīkāk aplūkojam diagnostiskos kritērijus un dažādas diagnostiskās pieejas, svarīgi ir zināt, kuros gadījumos jāizvērtē ĢH iespējamība konkrētam pacientam, kas mūsu redzeslokā var būt nonācis dažādu iemeslu dēļ. Ja konkrētais pacients ir pirmais no savas ģimenes, kam tiek izvērtēta ĢH diagnoze, viņš tiek saukts par probandu jeb indeksa gadījumu. Eiropas Aterosklerozes biedrība un Eiropas Kardiologu biedrība rekomendē, ka aizdomām par ĢH jārodas un detalizētāka izmeklēšana jāveic, ja:
- konstatēts KH līmenis > 8 mmol/l pieaugušam pacientam (> 6 mmol/l bērnam) vai viņa ģimenes loceklim;
- pierādīta agrīna KSS pašam pacientam vai ģimenes loceklim (< 55 gadus vecam vīrietim un < 60 gadus vecai sievietei);
- cīpslu ksantomas pašam pacientam vai ģimenes loceklim;
- zināma pēkšņa kardiāla nāve ģimenes loceklim.
Klīniskajā praksē KH līmenis (nereti tas joprojām ir vienīgais lipīdu parametrs, kas pacientam sākotnēji ir dokumentēts) uzskatāms par pirmo signālu tam, ka jāveic pilna lipidogramma: ZBLH, augsta blīvuma lipoproteīnu holesterīns (ABLH), triglicerīdi (TG). Turpmākai ĢH izvērtēšanai tiks izmantots ZBLH līmenis. Par nozīmīgi paaugstinātu, lai būtu mērķtiecīga ĢH izvērtēšana neārstētam pacientam, kopumā tiek uzskatīts ZBLH > 5 mmol/l, taču jāpiebilst, ka nav ieteicams vērtēt lipīdu līmeni izolēti, jo jaunākā vecumā un pie optimāla dzīvesveida šie skaitļi var būt zemāki un, vērtējot izolēti, pat radīt maldīgu priekšstatu, ka pacienta riska pakāpe ir nebūtiska. Attiecībā uz TG līmeni — klasiski ĢH pacientam TG līmenis ir sagaidāms normāls, taču paralēli konstatēta hipertrigliceridēmija neizslēdz ĢH diagnozi.
Ikdienas praksē ģimenes loceklis primāri tiek saprasts kā 1. pakāpes radinieks (vecāki, bērni, brāļi/māsas), šī radniecības pakāpe ir iekļauta diagnostikas kritērijos. Turpmāk, veidojot ģimenes ciltskoku un analizējot iespējamo ĢH izplatību dzimtā, būtiska var būt arī informācija par 2. pakāpes radiniekiem (vecvecāki, mazbērni, pusbrāļi/pusmāsas, vecāku brāļi/māsas, brāļi/māsu bērni).
Diagnostiskie kritēriji
Gan Eiropas Kardiologu biedrības vadlīnijas, gan Eiropas Aterosklerozes biedrības rekomendācijas par efektīvu diagnostisko instrumentu pirmreizējai ĢH izvērtēšanai atzīst Nīderlandes Lipīdu klīniku tīkla (Dutch Lipid Clinic network, DLCN) kritērijus (tabulā). [2] Šos kritērijus pirmreizējai diagnostikai izmanto arī LĢHR.


Tabula
Nīderlandes Lipīdu klīniku tīkla izstrādātie ģimenes hiperholesterinēmijas diagnostiskie kritēriji
Pēc iegūtā punktu skaita (no katras grupas tiek ņemts vērā viens kritērijs ar lielāko punktu skaitu, piemēram, ja ģimenes anamnēzē ir gan agrīna KSS (1 punkts diagnostikas skalā), gan ksantomas (2 punkti), tad kopējā vērtējumā no ģimenes anamnēzes sadaļas tiek ieskaitīti 2, nevis 3 punkti) ĢH tiek definēta kā:
- droša (definite) > 8 punktiem,
- ticama (probable) 6—8 punkti,
- (droša un ticama ĢH = klīniska ĢH),
- iespējama (possible) 3—5 punkti.
Ja punktu skaits ir zem 3, tad pēc pieejamās informācijas izvērtēšanas brīdī (!) nav pietiekamu datu par ĢH.
Termins “> 95. procentile” ģimenes anamnēzes sadaļā labāk pazīstams un ikdienā lietojams pediatriem un ģimenes ārstiem, kuru aprūpē ir bērni, — tas nozīmē, ka konkrētajā gadījumā pacienta ZBLH līmenis ir virs konkrētajam dzimumam un vecumam atbilstošās 95. procentiles, tātad 95 % visu indivīdu šai dzimuma un vecuma grupā ZBLH ir zemāks nekā pacientam. Tā kā Latvijas populācijā nav veikti šādi epidemioloģiski pētījumi, tad LĢHR praksē tiek izmantota Nīderlandes speciālistu atzīta vecumam un dzimumam atbilstoša lipīdu rādītāju procentiļu sistēma (pieejama elektroniski), pieņemot, ka mūsu un Nīderlandes populācijā nav ļoti nozīmīgu atšķirību (3. attēls).
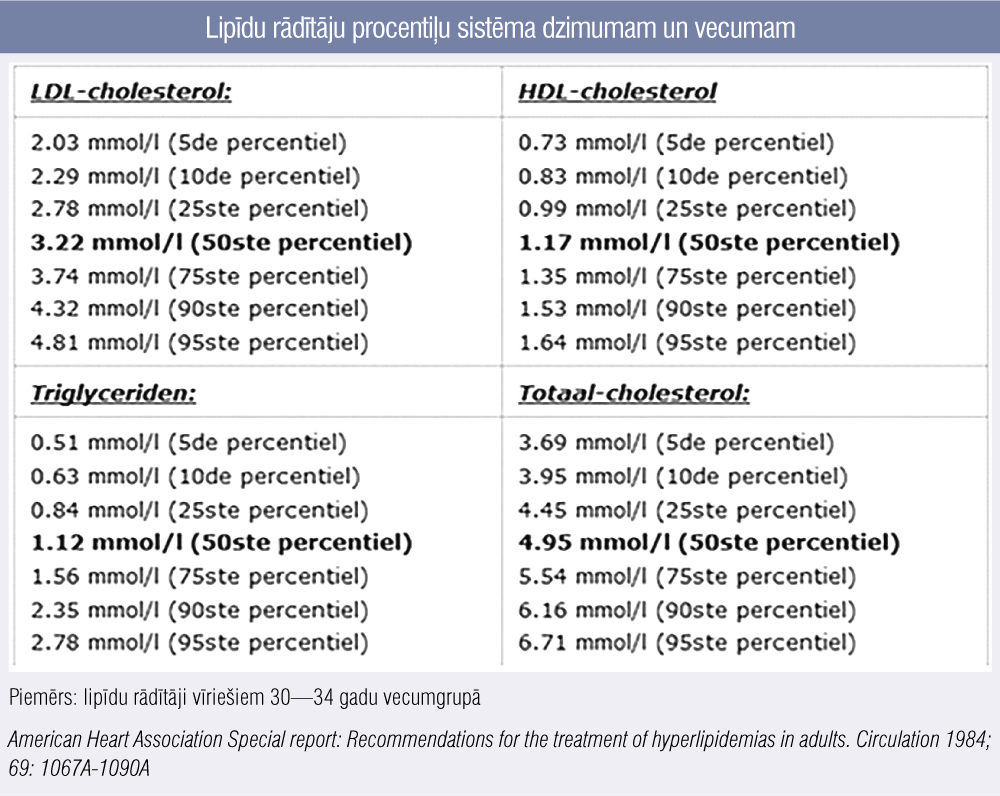

3. attēls
Lipīdu rādītāju procentiļu sistēma dzimumam un vecumam
Vizuāli novērojamas pazīmes un klīniskie piemēri
Redzams, ka ĢH ir divas specifiskas fizikālas pazīmes, kuru attīstību nosaka tieši ilgtermiņa ZBLH akumulācija asinsritē, pirmām kārtām cīpslu ksantomas. To sastāvs pēc būtības ir līdzīgs aterosklerotiskajai plātnei, jo histoloģiski sastāv no putu šūnām, kas formējušās no makrofāgiem pēc intensīvas ZBLH fagocitēšanas, tātad to izveidošanās iespējama tikai ilgtermiņa ekspozīcijā pret augstu cirkulējošo ZBLH. [7]
Ksantomu konstatēšana dod sešus pun-ktus ĢH diagnostikas skalā un, ja nav šaubu, ka konstatētais veidojums ir ksantoma, ar šo faktu ir pietiekami, lai iegūtu sešus punktus un attiecīgi tiktu diagnosticēta klīniska ĢH. Ņemot vērā šā kritērija būtisko nozīmi diagnostikā, Eiropas Aterosklerozes biedrības eksperti rekomendē cīpslu ksantomu diagnostiku veikt ne tikai vizuāli un palpatori, bet arī ar USG, kas nozīmīgi palielina atklāto ģimenes hiperholesterinēmijas pacientu skaitu. [1; 2]
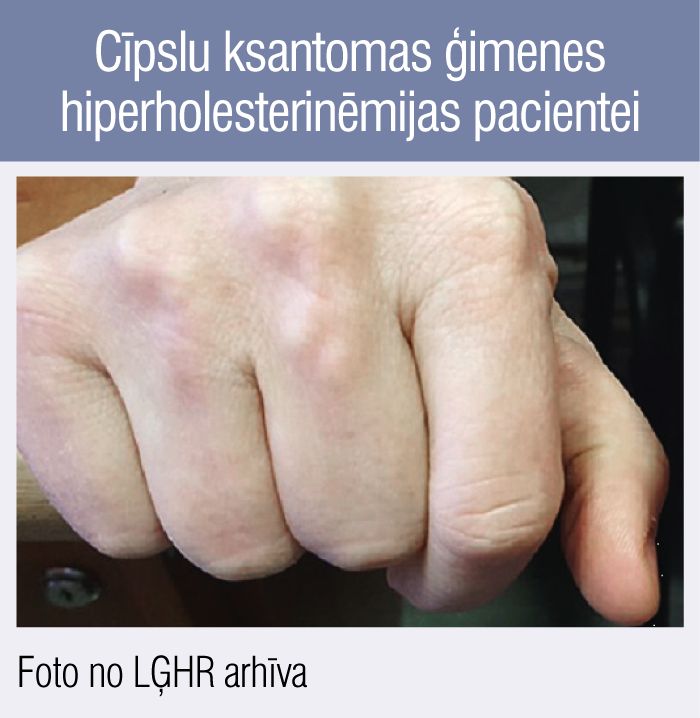

4. attēls
Cīpslu ksantomas ģimenes hiperholesterinēmijas pacientei
Cīpslu ksantomas piemērs
Cīpslu ksantomas LĢRH pacientei uz plaukstas ekstensoru cīpslām (4. attēls). Pacientei pirmās vizītes laikā 56 gadi, ilgtermiņa zināmie lipīdi pirms terapijas sākšanas: KH 16,7 mmol/l, ZBLH 10,1 mmol/l. Klīniski — slodzes stenokardija, konstatēta smaga trīs artēriju slimība, ir veikta koronāra šuntēšana. Salīdzinājumam jāmin, ka USG brahiocefālajiem asinsvadiem konstatētas tikai nestenozējošas pangas.
Arcus senilis
Otra fenotipiskā ĢH pazīme ar mazāku specifiskumu ir t.s. arcus cornealis (lipīdu depozīti radzenē), pazīstama arī kā arcus senilis. Šā fenomena atradei kā ĢH diagnostiskajam kritērijam nozīme ir tikai gadījumā, ja konstatēts līdz 45 gadu vecumam.
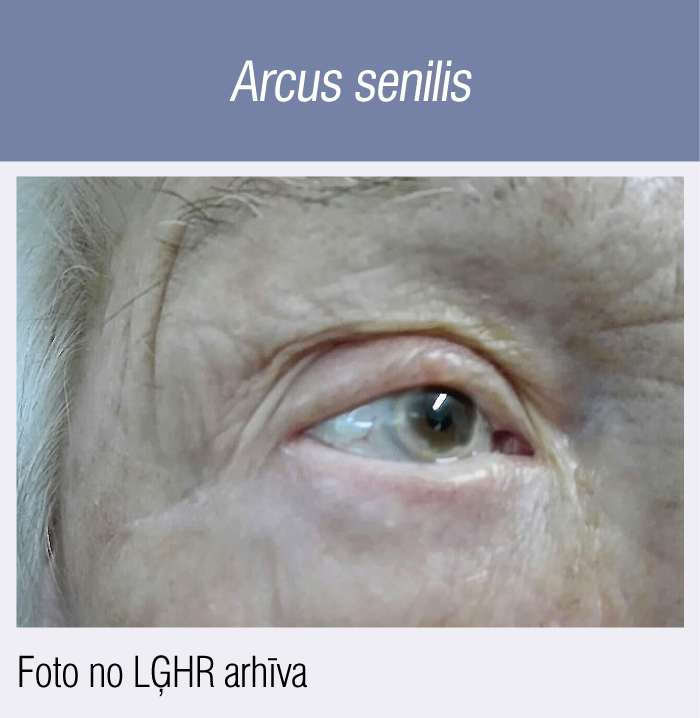

5. attēls
Arcus senilis
Piemērs (5. attēls): izteikts arcus senilis 86 gadus vecai LĢHR pacientei (šajā gadījumā pacientes vecuma dēļ tas nav uzskatāms par diagnostisko kritēriju, konkrētajai pacientei klīniski droša ĢH tika diagnosticēta, ņemot vērā dokumentētu ZBLH 9,3 mmol/l (8 punkti pēc DLCN) un meitai dokumentētu ZBLH 8,3 mmol/l (vēl + 1 punkts pēc DLCN). Kardiologa redzeslokā paciente nonāca sakarā ar smagu trīs artēriju slimību, ilgstošu slodzes stenokardiju III FK, taču arī tas pacientes vecuma dēļ nav uzskatāms par diagnostisko kritēriju ĢH diagnosticēšanas brīdī.
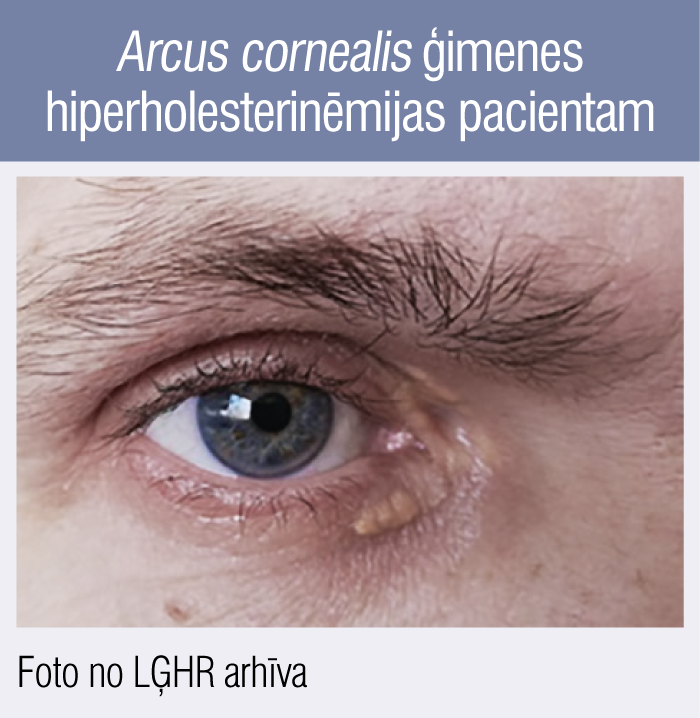

6. attēls
Arcus cornealis ģimenes hiperholesterinēmijas pacientam
Otrs piemērs: arcus cornealis (radzenes lejasdaļā, 6. attēls) un ksantelazmas (holesterīna depozīti zem-ādā, kas gan nav iekļauti ĢH diagnostiskajos kritērijos, jo daļā gadījumu var būt attīstījušies arī bez hiperlipidēmijas) 44 gadus vecam LĢHR pacientam. Konkrētajam pacientam LĢHR pirmajā vizītē klīniski jau ir tipiska slodzes stenokardija II FK (2 punkti pēc DLCN), ir arcus cornealis (44 gadu vecumā tas ir ĢH diagnostiskais kritērijs, t.i., + 4 punkti pēc DLCN), augstākais ZBLH datēts 10,1 mmol/l (+ 8 punkti pēc DLCN, šobrīd ZBLH pēc pusgadu ilgas rosuvastatīna 10 mg un ezetimiba 10 mg lietošanas sasniedzis 5,6 mmol/l, bet kā diagnostiskais kritērijs izmantojams augstākais dokumentētais līmenis), no anamnēzes zināms, ka tēvam bijis miokarda infarkts 42 gadu vecumā (+ 1 punkts pēc DLCN). Šajā konkrētajā gadījumā ar klīniskajiem kritērijiem vienas vizītes laikā (bez ģenētiskās izmeklēšanas) ir vairāk nekā pietiekami, lai tiktu diagnosticēta droša ĢH.
Atbilstīgi klīniskajai ainai pirmajā vizītē maksimālai akūta koronāra notikuma profilaksei tika palielināta rosuvastatīna deva līdz maksimālajai, t.i., 40 mg, terapijā pievienots aspirīns 100 mg, nākamā vizīte šim pacientam notika jau sirds asinsvadu katetrizācijas laboratorijā, kur koronarogrāfijā konstatēja hemodinamiski nozīmīgu stenozi (pacientam ir klīnika) kreisajā lejupejošajā koronārajā artērijā un veica angioplastiju ar stenta implantāciju. Minētā artērija apasiņo nozīmīgu kreisā kambara muskuļa daļu, un infarkta gadījumā, kas būtu veidojies, plīstot atero-sklerotiskajai plātnei un veidojoties trombotiskai masai šajā lokalizācijā, otrs ļaunākais scenārijs pēc pēkšņas nāves varētu būt smaga sirds mazspēja, kas raksturīga savlaicīgi nerevaskularizētam priekšējās sienas infarktam.
Otrajā vizītē iegūta papildu informācija: pacienta dēli (vecumgrupās 15—20 gadi un 20—25 gadi) veikuši lipīdu analīzi un iegūtie ZBLH rādītāji attiecīgi 6,2 mmol/l un 7,3 mmol/l pat neprasa procentiļu tabulu, lai arī šiem jauniešiem diagnosticētu klīnisku ĢH un šā fakta konstatēšanas brīdī sāktu lipīdu līmeni pazeminošu terapiju.
ĢH — augsta riska līmeņa pacients
Droša un ticama ĢH diagnoze, kas noteikta pēc šiem kritērijiem, uzskatāma par klīniski diagnosticētu ĢH, un no tā izriet slēdziens, ka turpmākajai šā pacienta aprūpes taktikai jāatbilst augsta riska līmeņa pacienta profilam (pēc vispārzināmajām dislipidēmiju korekcijas vadlīnijām ĢH diagnoze per se pacientu ierindo augsta riska līmeņa kategorijā un klīniskas ĢH diagnozes gadījumā vispārpieņemtā riska izvērtēšana pēc SCORE nav attiecināma).
Ja ĢH tiek konstatēta brīdī, kad pacientam jau attīstījusies dokumentēta aterosklerotiska slimība, tad pacients neatkarīgi no ĢH statusa uzskatāms par ļoti augsta riska līmeņa pacientu ar no tā izrietošu terapijas taktiku un mērķiem. Tad ĢH diagnosticēšana mazāk ir paša pacienta interesēs (ĢH diagnoze izskaidros slimības pamatcēloni, taču būtiski neietekmēs taktiku), bet pamatā pacienta 1. pakāpes radinieku interesēs, lai nebūtu jāpiedzīvo koronārs notikums un lai konstatētu ĢH un sāktu terapiju. [1; 2]
Kaskādes sijājošā diagnostika
Būtiski, ka DLNC diagnostiskā skala izmantojama tikai ĢH diagnostikā probandiem jeb pirmajiem no savas ģimenes. Konstatējot klīnisku ĢH, nākamais solis ir kaskādes sijājošā diagnostika sākotnēji 1. pakāpes radiniekiem — praksē tas nozīmē lipīdu analīzes un rezultāta interpretēšanu pēc dzimumam un vecumam atbilstošās procentiļu sistēmas. Ja konkrētais KH un/vai ZBLH rezultāts ir > 95. procentiles, tad ĢH diagnoze klīniski uzskatāma par apstiprinātu. [1] Praktisks kaskādes sijājošās diagnostikas piemērs sniegts klīniskā gadījuma aprakstā iepriekš.
Kaskādes sijājošās diagnostikas ilustrēšanai un vienlaikus kontrastam ar iepriekš minētajiem piemēriem, kur vienas vizītes laikā, izmantojot DLCN skalu, iespējams konstatēt ĢH pirmajam savas ģimenes pārstāvim, minams cits gadījums no LĢHR pieredzes, kur šīs skalas izmantošana novestu pie nediagnosticētas ĢH un ļaunākā scenārija gadījumā vēl viena agrīna infarkta ģimenē.
Klīniskais piemērs
Pacients, 34 gadus vecs, ar šādiem datētiem augstākajiem lipīdu rādītājiem: KH 6,6 mmol/l un ZBLH 4,6 mmol/l (uzkrītoši zemāki nekā iepriekšējos klīniskajos gadījumos). Pacients ir izteikti veselīga dzīvesveida piekritējs (kas lielā mērā izskaidro salīdzinoši ne tik augstu lipīdu līmeni), ikdienas pašsajūta un slodzes panesība nav traucēta, LĢHR vērsies, atsaucoties kardiologa uzaicinājumam sakarā ar faktu, ka brālim 38 gadu vecumā bijis infarkts, konstatēta smaga trīs artēriju slimība un veikta koronāra šuntēšana. Pieejamie dati liecina, ka jau statīnu lietošanas fonā pēc infarkta brāļa ZBLH līmenis bijis 5,2 mmol/l, pirms infarkta bez terapijas fona lipīdi nav bijuši noteikti.
Ja konkrētā pacienta ĢH diagnozes iespēja tiktu vērtēta pēc DLCN kritērijiem identiski iepriekšējiem gadījumiem, tad pēc pieejamās informācijas un zināmajiem faktiem tiktu iegūti tieši 2 punkti — tātad datu par ĢH nav. Ņemot vērā zināmo ģimenes anamnēzi, pacienta ĢH diagnozes varbūtība tika vērtēta pēc kaskādes sijājošās diagnostikas principa samērīgi dzimumam un vecumam atbilstīgajām procentilēm (populācijas rādītāji 34 gadus vecam vīrietim kā piemērs skatāmi 3. attēlā). Secināms, ka pacienta rādītāji atbilst 90. procentilei, bet, ņemot vērā veselīgā dzīvesveida ietekmi (vēl vairāk pārskatot uztura paradumus un jau izejas līmenī optimālu ēšanas režīmu būtībā padarot par ideālu, dokumentēts arī ZBLH līmenis 4,2 mmol/l), tiek lemts, ka pacients tomēr atbilst ĢH diagnozei.
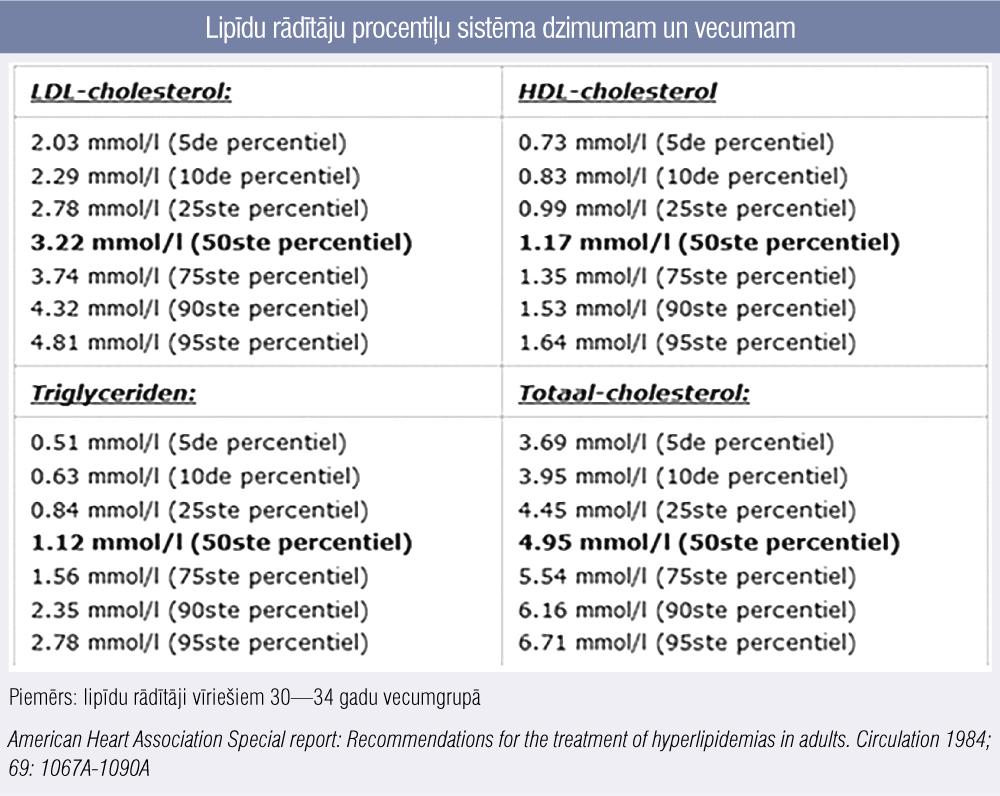

3. attēls
Lipīdu rādītāju procentiļu sistēma dzimumam un vecumam
Riska precizēšanai konkrētajam pacientam plāna kārtā tika veikta USG brahiocefālajiem asinsvadiem, kur konstatēta panga ar 10 % stenozi, un sekojoši datortomogrāfijas koronārā angiogrāfija, kur atklāta 80 % stenoze priekšējā lejupejošajā koronārajā artērijā. Tā kā pacients ir pilnībā asimptomātisks, ko apliecina veloergometrija un stresaEhoKG bez inducējamas išēmijas, invazīva taktika netiek lietota, bet pacientam tiek parakstīta terapija ar atorvastatīnu 80 mg un aspirīnu 100 mg. Lipīdu līmeni pazeminošās terapijas fonā pacientam tiek sasniegts KH 3,3 mmol/l un ZBLH 1,2 mmol/l, reizi gadā tiek veikta kontroles veloergometrija.
Ģenētiskā izmeklēšana
Līdzšinējie piemēri ilustrē ĢH diagnostiku gan probanda, gan kaskādes sijājošās diagnostikas posmā bez ģenētiskās izmeklēšanas, kas nav LĢRH rutīna galvenokārt pieejamības dēļ, taču piemēri ilustrē, ka šis izmeklējums no klīniskā viedokļa nav nepieciešamība visos gadījumos.
Gan Eiropas Kardiologu biedrības vadlīnijas, gan Eiropas Aterosklerozes biedrības rekomendācija iesaka primāri izmantot DLCN kritērijus un visos iespējamos gadījumos arī ģenētisko izmeklēšanu kā galīgo apstiprinājumu. 2018. gada FHSC ziņojumā sadaļā par pieņemto ĢH diagnostikas taktiku katrā konkrētajā valstī kā rutīnā veicamu izmeklējumu to norāda tikai Šveices, Norvēģijas un Polijas ĢH speciālisti, savukārt Slovēnijā valsts programmas ietvaros tiek veikta ģeneralizēta KH noteikšana visiem bērniem 5 gadu vecumā, kurai virsnormas KH gadījumos seko ģenētiskā izmeklēšana. Eiropas valstu (piemēram, Austrijas, Nīderlandes, Beļģijas, Somijas, Francijas, Vācijas, Īrijas, Spānijas) vadošie ĢH speciālisti ziņojumos minējuši, ka ikdienas rutīnā pamata instruments ĢH noteikšanai ir tieši DLCN kritēriji. [3]
Ģenētiskā izmeklēšana vislielāko pievienoto vērtību sniedz gadījumos, kad jau konkrētas, probandam konstatētas ĢH kauzālas mutācijas klātbūtne tiek meklēta kaskādes sijājošās diagnostikas ceļā, īpaši, ja izmeklējamie ir gados jauni, ar relatīvi zemiem lipīdu rādītājiem, kas tuvojas 90.—95. procentilei, bet to nepārsniedz. Nākamais klīniskais gadījums ilustrē LĢRH pieredzi ar ģenētisko izmeklēšanu kaskādes sijājošā diagnostikā.
Klīniskais gadījums
Pirmreizējā savas ģimenes pārstāve — 47 gadus veca sieviete LĢHR vērsusies sakarā ar zināmu datētu ZBLH līmeni 8,3 mmol/l un ģimenes anamnēzi, kur mātei slodzes stenokardijas klīnika attīstījusies apmēram no 50 gadu vecuma un līdz 60 gadu vecumam jau veikta koronāra šuntēšana. Pašai pacientei sūdzību nav, slodzi ierobežojošu simptomu nav, taču fizikālajā izmeklēšanā palpatori tiek konstatētas cīpslu ksantomas. Iepriekšminētie fakti pēc DLCN kritērijiem nosaka klīniski drošu ĢH diagnozi (summāri 12 punkti). Arī šai pacientei plāna kārtā tiek veikta USG kakla asinsvadiem, kur konstatē pangas ar maksimāli 20 % stenozi, un DT angiogrāfija koronārajiem asinsvadiem, kas atklāj difūzu aterosklerozi ar kalcinātiem un jaukta tipa pangām ar lūmenu stenozēm līdz 80 %. Turpmākā taktika ir līdzvērtīga iepriekš aprakstītajam klīniskajam gadījumam: tā kā KSS ir asimptomātiska arī stresa EhoKG izmeklējumā, pacientei parakstīta medikamentoza terapija — rosuvastatīns 40 mg + ezetimibs 10 mg + aspirīns 100 mg. Diemžēl divos apsekošanas gados ZBLH līmeni izdevies pazemināt līdz 3,0 mmol/l un šī paciente ir kandidāte terapijai ar PCSK9 inhibitoru (sīkāks apraksts terapijas sadaļā).
Pacientei ir divi bērni. Pirmreizējā vizītē LĢHR dēlam 25 gadu vecumā noteikts ZBLH 4,8 mmol/l (> 95. %, bet klīnisko spriedumu apgrūtina fakts, ka ir gan ievērojams liekais svars, gan izteikti neveselīgs ēšanas režīms, kas arī var izskaidrot šāda līmeņa ZBLH paaugstinājumu), meitai 21 gada vecumā ZBLH 6,0 mmol/l (pirmajā vizītē arī ir aktuāls virssvars un neoptimāls ēšanas režīms, bet šie faktori tomēr tik augstu ZBLH līmeni neizskaidro un šajā gadījumā kaskādes sijājošās diagnostikas procesā tiek diagnosticēta ĢH).
Šī ir viena no ģimenēm, kam veikta ģenētiskā izmeklēšana — jaunās paaudzes genoma sekvencēšana (next generation sequencing), mātei konstatēta ĢH kauzāla mutācija ApoB–100 gēnā. Pēc tam šīs pašas mutācijas klātbūtne pārbaudīta abu bērnu genomā un konstatēta meitai, bet ne dēlam. Ja šajā gadījumā ĢH ģenētiskais apstiprinājums ne mātei, ne meitai pēc būtības nemainīja ne diagnozi, ne taktiku (jo ĢH jau sākotnēji klīniski bija pārliecinoši diagnosticēta), tad dēla gadījumā fakts, ka nav pārmantota konkrētā ĢH kauzālā mutācija, ļāva secināt, ka konkrētais viņa holesterīna līmenis ir nevis ilgstošas akumulācijas izraisīts, bet dzīvesveida noteikts un atšķirībā no māsas šā brīža hiperholesterinēmija viņu neierindo augsta riska kategorijā un attiecīgi šobrīd neprasa apsvērt medikamentozu terapiju.
Diagnostikas metožu salīdzinājums
Ģenētiskās vs. klīniskās ĢH diagnosticēšanas salīdzinājums analizēts Eiropas Aterosklerozes biedrības ekspertu slēdziena rekomendācijā, ĢH diagnostikā un terapijā (7. attēls), par pamatu ņemot pētījumu Spānijā, kur ģenētiskā izmeklēšana veikta 5430 probandiem ar diagnosticētu ĢH pēc DLCN kritērijiem un 2223 radiniekiem.
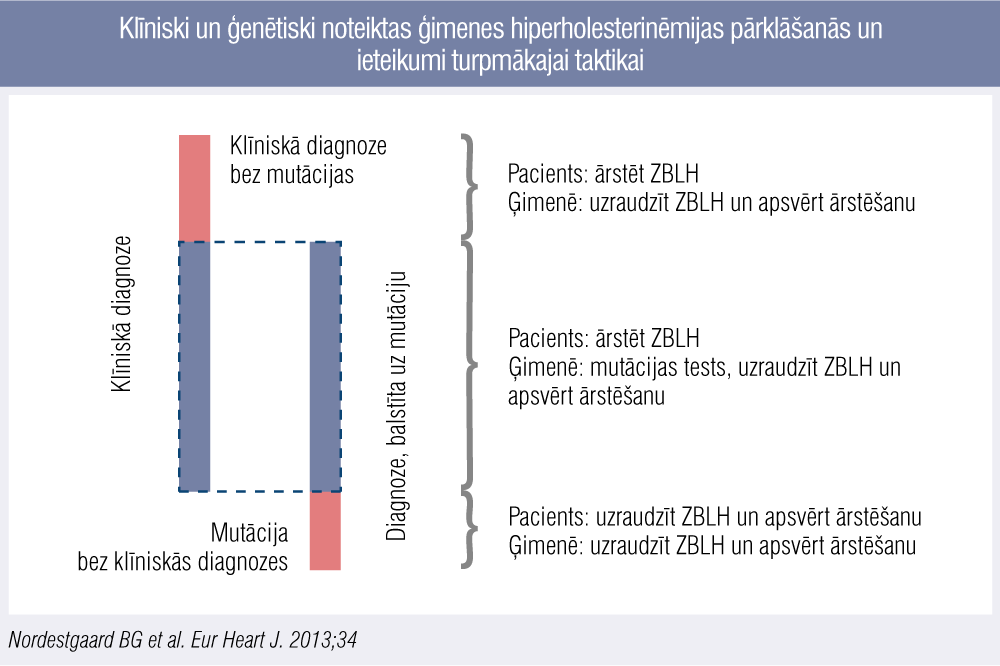

7. attēls
Klīniski un ģenētiski noteiktas ģimenes hiperholesterinēmijas pārklāšanās un ieteikumi turpmākajai taktikai
Redzams, ka aptuveni pusei pacientu diagnoze apstiprināta gan klīniski, gan ģenētiski, bet daļai arī šajā pētījumā ĢH diagnoze noteikta tikai klīniski, taču no ikdienas prakses viedokļa ir būtiski, ka pacienta turpmākās aprūpes taktika ir nemainīga neatkarīgi no ģenētiski iegūta klīniskas ĢH apstiprinājuma. [1]
Tā kā ĢH rutīnas diagnostikas stūrakmens ir klīniskie kritēriji ar augstāko datēto ZBLH līmeni kā galveno parametru, būtiski pārliecināties, vai izteikti augstās KH un ZBLH koncentrācijas pamatā nav hipotireoze (TSH rādītājs) vai nefrotiskais sindroms (kopējā olbaltuma, albumīna līmenis serumā, urīna analīze). [2; 8]
Riska novērtēšana un terapija
Lai gan šie jautājumi vadlīnijās atspoguļoti ļoti tieši un konkrēti, tomēr ikdienas praktiskajā darbā rada diskusiju. Jau minēts, ka ĢH diagnoze per se pacientu ierindo augsta riska kategorijā, paredzot sasniedzamo ZBLH mērķi < 2,6 mmol/l pieaugušam ĢH pacientam. Riska kategorija no augstas mainās uz ļoti augstu (attiecīgi ar uzstādāmo ZBLH mērķi < 1,8 mmol/l) gadījumos, kad konstatēta aterosklerotiska slimība un/vai cukura diabēts (kā jebkuram pacientam neatkarīgi no ĢH diagnozes), kā arī specifiski ĢH gadījumā — ja diagnoze konstatēta pēc 40 gadu vecuma, kas skaidrojams ar ilgtermiņa ZBLH akumulācijas radīto slogu asinsritē.
Aktuālās Eiropas Kardiologu biedrības vadlīnijas (2016. gads) skaidri definē, ka par aterosklerotisku slimību uzskatāma ne tikai klīniska izpausme (akūts koronārs sindroms, miokarda infarkts, veikta revaskularizācija), bet arī nešaubīgi dokumentēta panga koronārajā artērijā.
Ikdienas darbs ar ĢH pacientu pamatā orientēts uz aterosklerozes attīstības aizkavēšanu un akūta koronārā sindroma attīstības novēršanu, un šeit viens no lielākajiem izaicinājumiem ir koronāri asimptomātiski pacienti, jo nav datu par to, cik tālu no potenciāla akūta koronāra sindroma viņi atrodas — iespējams visplašākais koronāro artēriju bojājuma spektrs: no iniciālas koronāras aterosklerozes bez lūmena sašaurinājuma līdz multiplām lūmenu sašaurinošām augsta riska jeb nestabilajām pangām ar lielu iespējamas ruptūras risku.
Ja pangu konstatēšana per se pacientu novirza ļoti augsta riska kategorijā, izvirzot zemāku ZBLH mērķi, kura sasniegšanai jākoriģē terapija, tad nozīmīgi lūmenu sašaurinošu, mīkstu vai pat erozīvu pangu atrade no klīniskā viedokļa pamato aspirīna pievienošanu primārajā profilaksē. Minētās izmaiņas, kas var būtiski ietekmēt terapiju, iespējams diagnosticēt tikai ar vizualizācijas metodēm (neinvazīvākā no tām — datortomogrāfijas angiogrāfija).
Būtiski, ka funkcionālie testi (veloergometrija, stresa ehokardiogrāfija, miokarda perfūzijas scintigrāfija) negatīva rezultāta gadījumā izslēdz tikai hemodinamiski nozīmīgu, išēmiju radošu un revaskularizāciju pieprasošu bojājumu, bet nekādā ziņā neizslēdz anatomiska bojājuma esību, kura attīstības varbūtība ĢH pacientam ir īpaši liela. Lai gan minētajās vadlīnijās netiek rekomendēta vizualizācijas metožu rutīnas izmantošana riska precizēšanai, LĢHR kardiologu skatījumā ĢH pacientiem ar īpaši augstu ZBLH līmeni, agresīvu aterosklerozes norisi ģimenes anamnēzē un citiem paralēliem riska faktoriem datortomogrāfijas koronārā angiogrāfija var sniegt papildu informāciju, kas ietekmē turpmāko taktiku.
Apskatītie klīniskie piemēri nav kazuistika LĢHR praksē. 2017. gadā LĢHR ietvaros tika analizēta gados jaunu (< 55 gadus veci vīrieši un < 60 gadus vecas sievietes) asimptomātisku ĢH pacientu grupa (n = 39), kam veikta datortomogrāfijas koronārā angiogrāfija: tikai 11 no tiem netika konstatētas izmaiņas koronārajos asinsvados, bet 18 pacientu grupā tika konstatētas koronāras pangas ar dažādas pakāpes stenozēm (maksimāli 90 %), savukārt jaunākais pacients, kam šādi konstatēta agrīna koronāra ateroskleroze, bija 28 gadus vecs.
Klīniski vai ģenētiski pierādītas ĢH gadījumā lipīdu līmeni pazeminoša terapija paralēli dzīvesveida un uztura režīma korekcijai pēc vadlīnijām ir sākama ĢH diagnosticēšanas brīdī, lai iespējami aizkavētu procesu: aterogēna hiperlipidēmija → ateroklerotiskās pangas veidošanās → pangas augšana → pangas nestabilitāte → pangas plīsums. Augsta ZBLH koncentrācija plazmā ir stūrakmens pangas veidošanās procesam, savukārt augsts ZBLH saturs pangas iekšienē ir stūrakmens pangas nestabilitātei un plīšanas riskam. Pamata risinājums ir maksimāla ZBLH koncentrācijas mazināšana plazmā, tālāk sagaidāma arī subendoteliāli nonākošā ZBLH koncentrācijas mazināšanās jau izveidotajā pangā: jo mazāka pret to vērstā iekaisuma reakcija, jo proporcionāli mazāka pangas lipīdu serde; jo vairāk telpas pangu nosedzošās fibrozās kapsulas izveidei, jo stabilāka panga. [2; 8]
Pirmās izvēles medikamenti
Pirmās izvēles medikamentu grupa ĢH pacientu terapijā kā jebkuram koronāram vai potenciāli koronāram pacientam ir statīni. Medikamenta deva pielāgojama sasniegtajam ZBLH mērķim un panesībai. Tā kā izejas ZBLH līmenis ĢH pacientam jau pēc definīcijas ir augsts un mērķa rādītāji zemi, t.i., < 2,6 mmol/l primārajā profilaksē vai biežāk < 1,8 mmol/l situācijā, kad ateroskleroze jau attīstījusies, tad praksē lielākoties izmantojamas preparāta maksimālās devas (atorvastatīns 80 mg vai rosuvastatīns 40 mg) vai arī maksimālā panesamā deva muskuļu simptomu gadījumā.
Nākamais solis, ja netiek sasniegts ZBLH mērķis, ir holesterīna absorbcijas inhibitora ezetimiba pievienošana. Lielas devas statīna (par lielu devu uzskatāms atorvastatīns 40—80 mg un rosuvastatīns 20—40 mg) un ezetimiba kombinācija var panākt ZBLH redukciju līdz 70 % no sākotnējā līmeņa.
Otrās līnijas preparāti
Kā rezerves preparātu grupa ĢH terapijā apsverami žultsskābju sekvestranti (mūsdienīgākais grupas pārstāvis kolesevelams Latvijā nav pieejams; to pasūtot, jārēķinās ar apmēram 250 € mēnesī).
Jauna, klīniskajos pētījumos izcili sevi pierādījusi (gan lipīdu, gan pangas izmēru, gan arī kardiovaskulāro notikumu redukcijā) medikamentu grupa ir PCSK9 inhibitori — monoklonālās antivielas, kas saista PCSK9 molekulu un tādējādi ZBLH receptoru pasargā no destrukcijas un nodrošina ilgstošāku tā funkcionēšanu. Šobrīd šīs grupas medikamentiem nav valsts kompensācijas nevienam diagnozes kodam, taču perspektīvā pacientu kategorija, kam šī grupa ir visefektīvākā un lietošana vismērķtiecīgākā, ir pacienti ar agrīnu agresīvas norises aterosklerozi, kam ar maksimālo panesamo statīna devu kombinācijā ar ezetimibu nav izdevies sasniegt mērķa ZBLH līmeni vai arī ir dokumentēta aterosklerozes progresēšana, lai gan šis mērķis sasniegts. [2]