Krūts vēža hormonterapijas iespējas ir plašas. Kopš XIX gadsimta beigām līdz pat mūsdienām kā nederīga nav atmesta neviena. Taču visilgāk un visplašāk lietotais medikaments ir tamoksifēns. Ķīmiski tas ir trifeniletilēna transizomēra citrāts, kura antiestrogēnās īpašības nosaka dimetil-amino-etoksi- sānu ķēde un tās trans- konfigurācija. Bez tiešās mijiedarbes ar estrogēnu receptoriem tamoksifēns bloķē arī G1 fāzi un palēnina šūnu proliferāciju. Tādējādi to pamatoti var uzskatīt arī par citostātisku līdzekli. Tamoksifēna lietošanas indikācijās ietilpst gan krūts vēža adjuvantā terapija, gan metastāžu ārstēšana, kā arī to atļauts lietot vēža profilaksei sievietēm ar ļoti augstu krūts vēža attīstības risku. Turklāt pacientēm ar krūts vēzi tamoksifēnu (valsts kompensēts medikaments) izraksta ģimenes ārsts. Raksta ietvaros centīšos raksturot tamoksifēna lietošanas principus, sagaidāmās blaknes un iespējamās mijiedarbes ar citiem medikamentiem un terapijas novērošanu.
Darbības mehānisms
Tamoksifēna galvenais darbības mehānisms ir piesaistīšanās pie vēža šūnas estrogēnu receptora un tā inaktivēšana. Proti, tamoksifēna lietošanas laikā nemainās hormonu līmenis organismā kopumā, bet tiek modulēta endogēno hormonu, konkrēti - estrogēnu - bioloģiskā misija. Nespējot piesaistīties attiecīgajam receptoram, kuru jau ir aizņēmis tamoksifēns, estrogēns vairs nespēj bioloģiski ietekmēt audzēja šūnu un veicināt tās tālāku progresiju. Tādējādi tamoksifēna lietotājām organismā tiek radīta audzējam nedraudzīga vide. Tā kā tamoksifēns neietekmē cirkulējošo estrogēnu līmeni organismā, tad to var lietot gan sievietes menopauzē, gan reproduktīvā vecumā (aromatāzes inhibitorus rekomendē tikai sievietēm ar pārliecinošu menopauzi).


1. tabula
Hormonterapijas metodes
Jau septiņdesmito gadu beigās Makgeirs novēroja, ka tamoksifēns visefektīvāk darbojas sievietēm ar receptorus saturošiem audzējiem. Ja pozitīvi izrādījās abi receptori (estrogēnu (ER) un progesterona (PR)), tad sagaidāmā efektivitāte no tamoksifēna lietošanas bija 75-80% gadījumu, ER+/PR- 20-30%, ER-/PR+ 40-45%, ER-/PR- -
Jau deviņdesmito gadu beigās bija noskaidrots, ka tamoksifēns novērš katru otro recidīva gadījumu un katru trešo priekšlaikus nāves gadījumu (2. tabula).
![Ikgadējais negadījumu novēršanas biežums (%) ± SD tamoksifēna lietotājām [1]](https://cdn.doctus.lv/media/2011/10/2/original/868a3b50d91e.jpg)
![Ikgadējais negadījumu novēršanas biežums (%) ± SD tamoksifēna lietotājām [1]](https://cdn.doctus.lv/media/2011/10/2/original/868a3b50d91e.jpg)
2. tabula
Ikgadējais negadījumu novēršanas biežums (%) ± SD tamoksifēna lietotājām [1]
Turklāt minētais efekts saglabājās vēl arī pēc pieciem un deviņiem gadiem. Tamoksifēna efektivitāte bija atkarīga ne tikai no receptoru klātbūtnes, bet jo īpaši no to koncentrācijas šūnā (3. tabula).
![Ikgadējais negadījumu novēršanas biežums pēc piecu gadu tamoksifēna lietošanas – % (SD) atkarībā no steroīdu receptoru ekspresijas pakāpes vēža šūnās [1]](https://cdn.doctus.lv/media/2011/10/2/original/e8ff8c84e30c.jpg)
![Ikgadējais negadījumu novēršanas biežums pēc piecu gadu tamoksifēna lietošanas – % (SD) atkarībā no steroīdu receptoru ekspresijas pakāpes vēža šūnās [1]](https://cdn.doctus.lv/media/2011/10/2/original/e8ff8c84e30c.jpg)
3. tabula
Ikgadējais negadījumu novēršanas biežums pēc piecu gadu tamoksifēna lietošanas – % (SD) atkarībā no steroīdu receptoru ekspresijas pakāpes vēža šūnās [1]
Lielākais pozitīvais guvums gan attiecībā uz recidīva riska mazinājumu, gan dzīvildzes pagarinājumu vērojams pacientēm menopauzē, kaut arī reproduktīvā vecumā tamoksifēna lietošana, īpaši pacientēm ar ER/PR pozitīviem audzējiem, joprojām uzskatāma par labu terapijas izvēli (4., 5. tabula).
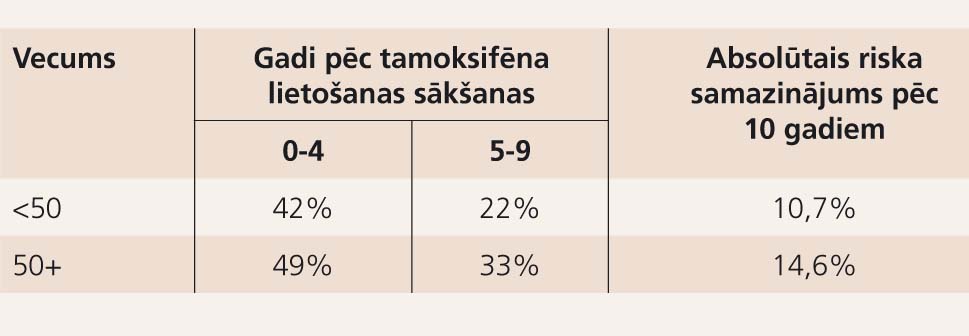

4. tabula
Recidīva riska samazinājums tamoksifēna lietotājām atkarībā no vecuma un tamoksifēna lietošanas ilguma
Vienlaikus zināmi vēl arī citi tamoksifēna iedarbības mehānismi. Piemēram, noskaidrots, ka tamoksifēns spēj ierosināt apopotozi vēža šūnās. Tāpat novērots, ka tamoksifēna klātbūtnē samazinās seruma IGF-1 un palielinās IGF-1 saistošā proteīna daudzums; palielinās SHBG daudzums un mazinās estrogēnu biopieejamība (?), pieaug TGF b daudzums un fibrozes veidošanās potenciāls (lietojot vienlaikus ar RT var palielināties fibrozes iespējamība) (?). Pastāv viedoklis, ka tamoksifēns selektīvi aktivē/inaktivē estrogēnu agonistu/antagonistu aktivitāti noteicošos koaktivatorus/korepresorus.
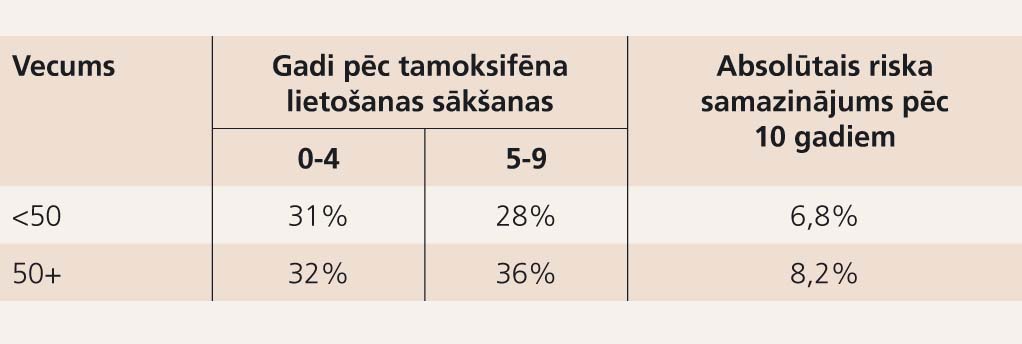

5. tabula
Nāves iespējamības samazinājums tamoksifēna lietotājām atkarībā no vecuma un tamoksifēna lietošanas ilguma
Lietošanas indikācijas
Šobrīd oficiāli atzītās tamoksifēna lietošanas indikācijas ir:
- metastātisks krūts vēzis pacientēm menopauzē (kopš 1977. gada);
- adjuvanta terapija kopā ar ķīmijterapiju pacientēm menopauzē ar metastāzēm paduses limfmezglos (kopš 1985. gada);
- adjuvanta monoterapija pacientēm menopauzē ar metastāzēm paduses limfmezglos (kopš 1986. gada);
- pacientēm ar metastātisku ER pozitīvu audzēju reproduktīvā vecumā (kopš 1989. gada);
- adjuvanta terapija pacientēm ar ER/PR pozitīviem audzējiem bez metastāzēm paduses limfmezglos gan reproduktīvā vecumā, gan menopauzē (kopš 1990. gada);
- metastātisks krūts vēzis vīriešiem (kopš 1993. gada);
- ER/PR pozitīva endometrija adenokarcinomas.
Tamoksifēnam aprakstīta arī virkne pagaidām vēl ikdienas praksē neakceptētu lietošanas indikāciju gan onkoloģijā, gan neonkoloģisku problēmu risināšanā (mastopātija, fibradenomas, neauglība, idiopātiska oligospermija, ginekomastija u. c.).
Devas un lietošana
Tamoksifēna standarta perorālā deva ir 20-40 mg dienā, sadalot to vienā vai divās ieņemšanas reizēs. Divu 10 mg devu ieņemšana divas reizes dienā ir bioekvivalenta vienreizējai 20 mg devas ieņemšanai. [2] Bijuši mēģinājumi lietot arī lielākas devas, taču būtisku terapeitiskā efekta pieaugumu tās nav uzrādījušas.
Maksimālo koncentrāciju asinīs pēc vienreizējas 20 mg devas ieņemšanas novēro pēc piecām stundām. Savukārt stabila tamoksifēna koncentrācija serumā tiek sasniegta tikai pēc apmēram četru nedēļu lietošanas. Tāpēc terapijas sākumā svarīgi ir neizlaist nevienu tableti.
Tamoksifēna eliminācijas puslaiks ir piecas līdz septiņas dienas, bet N-desmetiltamoksifēnam - 14 dienas. Tādējādi atsevišķu tablešu nejauša izlaišana kopējo terapijas efektivitāti neiespaido, un papildus devu izlaisto tablešu vietā lietot neiesaka.
Lai paātrinātu tamoksifēna piesātinājumu serumā, piemēram, pacientiem, kam netiek plānota ne operācija, ne ķīmijterapija, to var ordinēt pirmajā dienā pa 40 mg četras reizes dienā un tad terapiju turpināt ar standarta devu - 20 mg dienā. Šāds režīms pieļaujams arī trauslām vecāka gadagājuma pacientēm, kam tamoksifēnu plāno kā vienīgo ārstēšanas metodi. [3]
Tamoksifēnu vēlams lietot vienā un tai pašā laikā pirms vai pēc ēšanas, taču bez īpašām rekomendācijām to darīt noteiktās diennakts stundās. Dažkārt zāļu ieņemšana vakarā atvieglo terapijas sākumā vērojamo gastrointestinālo traucējumu subjektīvo slogu. Tableti ieteicams norīt veselu, to nesakošļājot.
Tamoksifēna farmakokinētika būtiski neatšķiras dažāda vecuma pacientēm. Netiek rekomendēta devas samazināšana pacientēm ar nieru vai aknu darbības traucējumiem, ja vien tamoksifēna lietošana vispār bijusi iespējama.
Tamoksifēna lietošanas laikā hormonālās kontracepcijas metodes var izrādīties nepietiekami drošas, tādēļ visieteicamākās šai laikā ir barjermetodes vai makstī ievadāmie spermatocīdie līdzekļi.
Lietošanas ilgums
Šobrīd vairākums ekspertu sliecas domāt, ka tamoksifēna lietošana ilgāk par pieciem gadiem pēc kārtas būtiski (un arī statistiski ticami) pacientes pozitīvo guvumu no šīs terapijas nepalielina. Tādēļ tamoksifēna standarta terapijas ilgums ir pieci gadi. Uzskatāmi tas parādīts 6. tabulā. [4]
![Pozitīvie guvumi atkarībā no tamoksifēna lietošanas ilguma [5]](https://cdn.doctus.lv/media/2011/10/2/original/21fc8da602bf.jpg)
![Pozitīvie guvumi atkarībā no tamoksifēna lietošanas ilguma [5]](https://cdn.doctus.lv/media/2011/10/2/original/21fc8da602bf.jpg)
6. tabula
Pozitīvie guvumi atkarībā no tamoksifēna lietošanas ilguma [5]
Savukārt kāds astoņu gadu novērojuma pētījums parādīja, ka tamoksifēns var negatīvi ietekmēt citotoksisko līdzekļu terapeitisko darbību, tādēļ autori rekomendē to sākt lietot pēc adjuvantās ķīmijterapijas pabeigšanas. [6]
Pēdējā laikā aizvien vairāk tiek diskutēts par jaunākas paaudzes aromatāzes inhibitoru (Arimedex, Aromasin, Femara) drošāku un efektīvāku lietošanu pacientēm ar krūts vēzi menopauzē. Taču pagaidām vienotas izpratnes par optimālo terapijas secību un ilgumu nav. Vieni autori iesaka terapiju sākt ar aromatāzes inhibitoriem un tikai to neefektivitātes gadījumā pāriet uz tamoksifēnu. Citi iesaka turēties pie zelta standarta un terapiju sākt ar tamoksifēnu un tikai pēc diviem, trīs vai pieciem gadiem pāriet uz aromatāzes inhibitoriem. Amerikas Klīniskās onkoloģijas asociācija šobrīd aromatāzes inhibitorus sievietēm menopauzē ar ER/PR pozitīviem audzējiem rekomendē gan kā pirmās, gan otrās kārtas medikamentus. Latvijā jautājumu par tamoksifēna terapijas sākšanu, turpināšanu vai mainīšanu lemj onkologs, vadoties no konkrētās klīniskās situācijas.
Kontrindikācijas un īpaši brīdinājumi
Izņemot īstu hipersensitivitāti pret tamoksifēna citrātu vai kādu no palīgvielām, kontrindikācijas galvenokārt attiecināmas uz sievietēm, kurām tamoksifēnu plāno vēža profilaksei (augsts individuālais saslimšanas risks) vai pacientēm ar in situ duktālu karcinomu. Te minama:
- vienlaicīga terapija ar kumarīna tipa antikoagulantiem;
- dziļo vēnu trombozes anamnēzē (nejaukt ar varikozi paplašinātām virspusējām vēnām!);
- plaušu embolija anamnēzē.
Tamoksifēna lietošana var radīt potenciāli bīstamas komplikācijas vai palielināt to attīstības risku. Tādēļ pirms terapijas sākšanas rūpīgi jānovērtē katras konkrētās pacientes citas jau esošās veselības problēmas, kā arī jāveic tamoksifēna terapijas regulāra kontrole. Iespējamās komplikācijas tamoksifēna lietotājām var būt:
- dzemdes ļaundabīgi audzēji (ilgstoši lietojot tamoksifēnu, pastāv potenciāli fatālas dzemdes sarkomas vai endometrija karcinomas attīstības risks);
- tamoksifēnu ordinējot vienlaikus ar ķīmijterapiju, palielinās trombembolisko komplikāciju risks (infarkts, dziļo vēnu trombozes, plaušu embolijas);
- ilgstoši lietojot, palielinās endometrija hiperplāzijas un/vai polipu, endometriozes, dzemdes fibromiomu attīstības vai tālākas progresijas risks;
- tamoksifēna ilgstoša lietošana var inducēt aknu darbības traucējumus (taukainā distrofija, holestāze, hepatīts, aknu nekroze, aknu enzīmu līmeņa paaugstināšanās);
- pacientēm ar metastāzēm kaulos tamoksifēns var papildus veicināt hiperkalcēmijas attīstību;
- tamoksifēns var paasināt jau esošās vai veicināt jaunas redzes orgānu patoloģijas (kataraktu, radzenes pārmaiņas, krāsu redzes traucējumus, tīklenes vēnu trombozi, retinopātiju);
- sievietēm reproduktīvā vecumā tamoksifēna lietošana var inducēt olnīcu cistu attīstību;
- pacientēm ar trombemboliskām komplikācijām anamnēzē tamoksifēna lietošana var palielināt atkārtotu trombemboliju risku.
Pacientēm ar metastātisku krūts vēzi tamoksifēna pozitīvais terapeitiskais guvums noteikti pārsniedz iespējamo nevēlamo blakusefektu risku.
Blaknes
Kopumā tamoksifēns ir labi panesams un vairumam lietotāju nekādas papildu veselības problēmas nerada. Svarīgi ir saprast un novērtēt katras konkrētās pacientes individuālo komplikāciju risku, jo anotācijā aprakstītie gadījumi ir tikai orientieris visu līdz šim zināmo un aprakstīto komplikāciju kopā. Te būtiski ir noskaidrot pacientes vispārējo veselības stāvokli, pārciestās slimības, esošos veselības traucējumus, lietotos medikamentus, medikamentu panesamību anamnēzē, kā arī pacientes psiholoģisko gatavību lietot šīs zāles. Nereti paciente pēc medikamenta anotācijas izlasīšanas atsakās to lietot vai, negūstot papildus skaidrojumu no ārsta puses, lieto bez motivācijas, haotiski, izlaižot ieņemšanas reizes vai pat patvaļīgi pārtraucot lietošanu.
Kardiovaskulāras komplikācijas [7]
Apjomīgā randomizētā placebo kontrolētā Krūts vēža profilakses pētījumā, kurā bija iekļautas pavisam 13 194 pacientes, četrus gadus ilga tamoksifēna lietošana, salīdzinot ar placebo, neradīja statistiski ticami biežākas kardiovakulāras komplikācijas, tai skaitā neatkarīgi no kardiovaskulārām slimībām anamēzē. Arī brahiālās artērijas diametra mērījumi neuzrādīja ticamas pārmaiņas tamoksifēna lietotājām, salīdzinot ar placebo grupu.
Ādas pārmaiņas [8]
Vairāku miljonu tamoksifēna lietotāju vidū zināmi tikai daži erythema multiforme, Stīvena Džonsona sindroma un pemphigus bullosus gadījumi. Ražotājam tas ir jānorāda medikamenta anotācijā, pat ja šo komplikāciju varbūtība ir tuvu nullei.
Līdz 5% gadījumu novēroti dažādi ādas izsitumi. Aprakstīts arī viens androgēnas alopēcijas un viens matu tumsnēšanas gadījums. Manā personīgajā praksē bijušas vairākas pacientes, kurām tamoksifēna terapijas laikā pastiprināti izkrituši mati, tie kļuvuši plānāki un trauslāki.
Pacientiem ar krūts vēža metastāzēm mīkstajos audos, ādā un zemādā nereti tamoksifēna terapijas sākumā novēro audzēja uzliesmojuma reakciju (tumor flare), kas izpaužas ar lokālu ādas apsārtumu, pietūkumu un sāpīgumu bojājuma vietā. Parasti minētās sūdzības pakāpeniski mazinās un nereti norāda uz labu vēlāko terapeitisko efektu. Līdzīga audzēja uzliesmojuma reakcija (sāpju pastiprināšanās) tamoksifēna terapijas sākumā iespējama arī pacientēm ar kaulu metastāzēm.
Endokrīnās un metabolās komplikācijas [9]
Literatūrā aprakstīts viens galaktorejas gadījums nedzemdējušai 31 gadus vecai pacientei. Galaktoreja turpinājusies visu tamoksifēna lietošanas laiku.
Menopauzes simptomu pastiprināšanos vai parādīšanos no jauna galvenokārt karstuma viļņu veidā novēro 33% tamoksifēna lietotāju. Dažkārt šie simptomi ir tik smagi, ka terapiju ar tamoksifēnu nācies pārtraukt.
Tamoksifēna lietotājām biežāk kā nelietotājām konstatētas maksts atrofijas pazīmes, kur labi palīdz topiskie estrogēnu preparāti.
Hiperkalcēmija ir samērā reta komplikācija, ko tiešā veidā varētu saistīt ar tamoksifēna lietošanu. Visbiežāk to konstatēja pacientēm ar lītiskām kaulu metastāzēm vai palielinātu kalcija līmeni serumā vēl pirms tamoksifēna terapijas sākšanas.
Literatūrā aprakstīti atsevišķi triglicerīdu līmeņa paaugstināšanās un porfīrijas gadījumi tamoksifēna lietotājām, tiesa saistībā jau ar iepriekšējām metabolām pārmaiņām (diabētu, dislipidēmiju). Savukārt kāds cits autors norādījis uz paaugstinātu A, D un E vitamīna un selēna līmeni tamoksifēna lietotāju serumā, to nesaistot ar uzņemto uzturu.
Gastrointestināli traucējumi [10]
Statistiski ticami biežāku šķebināšanas un vemšanas gadījumu skaitu NSABP B-14 pētījumā neizdevās pierādīt. Tamoksifēna lietotājām šīs komplikācijas novēroja 26% gadījumu, bet placebo grupā - 24% gadījumu.
Savukārt, veicot retrospektīvu kohortas pētījumu par 703 pacientēm, Eikins ar līdzautoriem konstatēja, ka tamoksifēns pārliecinoši biežāk inducēja žultsakmeņu attīstību. Tā, apsekojot tamoksifēna un placebo grupas pacientes, autori pēc 4,6 gadu novērojuma atklāja, ka žultsakmeņi de novo bija parādījušies 37% tamoksifēna lietotājām un tikai 2% placebo grupas pacientēm.
Hematoloģiskas blaknes [11]
Literatūrā pagaidām rodams tikai viens fatālas agranulocitozes gadījums, kas aprakstīts kādai pacientei pēc piecu mēnešu ilgstošas tamoksifēna lietošanas pa 20 mg divas reizes dienā. Tamoksifēna lietošanas laikā novērota viegla anēmija un/vai leikopēnija, kas nav bijisi pietiekami klīniski nozīmīga, lai pārtrauktu terapiju.
Savukārt kombinācijā ar ķīmijterapiju, ietekme uz asinsainu bijusi izteiktāka nekā lietojot tamoksifēnu vienu pašu. Daudz biežāk nekā anēmija un leikopēnija, tamoksifēna terapijas laikā novērota pārejoša trombocitopēnija.
Trombembolijas [12]
Veselu sieviešu vidū sešu mēnešu ilga tamoksifēna lietošanas ietekme uz antikoagulantu proteīnu līmeni pielīdzināma estrogēnu darbībai. Savukārt NSABP B-14 pētījums parādīja, ka trombembolijas, tai skaitā divas fatālas, attīstījās 1,7% sieviešu tamoksifēna grupā un tikai 0,4% placebo grupā. NSABP P-1 pētījumā dziļo vēnu trombozes novēroja 30 tamoksifēna un 19 placebo lietotājām. Tādējādi tika lēsts, ka trombožu attīstības risks, kalkulējot uz simts sievietēm gadā, tamoksifēna lietotāju vidū ir 1,26 (RR=1,59). Savukārt tamoksifēna lietošana vienlaikus ar CMF ķīmijterapiju trombembolisko komplikāciju risku palielināja, un tās novēroja 13,6% kombinētās terapijas grupā, salīdzinot ar 2,6% tamoksifēna grupā. Šī novērojuma autori pat izteica hipotēzi par mazu devu antikoagulantu terapijas mērķtiecīgumu.
Hepatotoksicitāte [13]
Aknu taukaino distrofiju Ogava ar līdzautoriem novērojis 36,4% slimnieču, kuras bija lietojušas tamoksifēnu pa 40 mg dienā trīs līdz piecus gadus pēc kārtas. Pēc tamoksifēna terapijas pārtraukšanas minētās pārmaiņas izzudušas 1-14 mēnešu laikā bez īpašas papildu koriģējošas terapijas. Vēl literatūrā rodamas norādes uz atsevišķiem hroniska aktīva hepatīta un aknu cirozes, kā arī hepatocelulāras nekrozes gadījumiem. Aknu vēža attīstība ilgstošām tamoksifēna lietotājām ir grūti pierādāma un domas par tamoksifēnu kā potenciālu etioloģisku faktoru dalās.
Neiroloģiskas komplikācijas [14]
Pacientēm ar metastātisku krūts vēzi, kuras terapijā saņēmušas tamoksifēna monoterapiju, novēroti atsevišķi depresijas, reiboņu un galvassāpju gadījumi. NSABP P-1 pētījums tiešu tamoskifēna saistību ar depresiju nepierādīja. Kāda metaanalīze parādīja, ka tamoksifēna lietotāju absolūtais išēmiska insulta attīstības risks ir 0,32%, bet jebkura veida insulta risks - 0,3%. Tādējādi kalkulētais Odds ratio insultam kopumā bija 1,29, bet išēmiskam insultam - 1,82.
Acu komplikācijas [15]
Katarakta un nepieciešamība pēc tās ķirurģiskas ārstēšanas biežāk novērota tamoksifēna lietotājām, salīdzinot ar placebo grupu. Tāpat tamoksifēna lietotāju grupā biežāk konstatēja kristālu veidošanos tīklenē un lēcas apduļķošanos, kā dēļ šī novērojuma autori visām sievietēm rekomendē regulāras ikgadējas oftalmoloģiskās pārbaudes. Citas acu patoloģijas, tādas kā toksiska retinopātija, keratopātija, optiskā diska tūska, asinsizplūdumi tīklenē, redzes pasliktināšanās un mākulas tūskainība, aprakstītas tikai atsevišķu gadījumu veidā.
Reproduktīvās sistēmas blaknes
Novērots, ka tamoksifēna lietošana ticami palielina labdabīgu olnīcu cistu attīstību. Šušans ar līdzautoriem tās novēroja 11% gadījumu, turklāt vidējais tamoksifēna lietošanas ilgums bija 19,4 mēneši menopauzē un 28 mēneši reproduktīvā vecumā. Pēc tamoksifēna lietošanas pārtraukšanas olnīcu cistas spontāni izzuda. [16]
Neskatoties uz to, ka tamoksifēns savulaik tika ieteikts kā alternatīvs līdzeklis danazolam endometriozes ārstēšanai, literatūrā rodamas atsauces uz atsevišķiem endometriozes uzliesmojuma un jaunattīstības gadījumiem tamoksifēna lietotāju vidū. Endometrija polipus tamoksifēna lietotāju vidū Koens ar līdzautoriem biežāk novēroja vecākām sievietēm ar garāku krūts vēža anamnēzi, lielāku svaru un biezāku endometrija slāni. Savukārt hormonu aizstājterapijas lietošana anamnēzē, īsāks laika periods līdz pirmā polipa parādīšanās brīdim kopš tamoksifēna terapijas sākšanas un tamoksifēna terapijas turpināšana var palielināt endometrija polipu recidivēšanās risku. [17]
Kādā pilotpētījumā par 57 krūts vēža pacientēm 54% no 41 dzimumdzīvi dzīvojošām sievietēm sūdzējās par dispareiniju. Šī pētījuma autori izteica arī hipotēzi, ka menopauzē tamoksifēns uz maksti iespējams darbojas kā estrogēnu agonists, bet reproduktīvā vecumā - vairāk kā antagonists. [18]
2% pacienšu, kuras saņēma tamoksifēnu, sūdzējās par maksts niezi, bet izdalījumi no dzimumceļiem novēroti līdz pat 30% tamoksifēna lietotāju, salīdzinot ar 15% placebo grupā.
NSABP P-1 pētījumā neregulāras menstruācijas tika konstatētas 25% tamoksifēna lietotāju vidū un 19% placebo grupā. Savukārt klīniskos pētījumos reproduktīva vecuma pacientēm ar metastātisku krūts vēzi tamoksifēna lietošana 16% inducēja amenoreju, 13% menstruālā cikla traucējumus un 9% oligomenoreju.
Taču vislielākais bieds tamoksifēna lietotāju vidū ir iespējama ļaundabīga audzēja attīstība dzemdē. [19]
Tā kāds valsts mēroga gadījuma kontroles pētījums parādīja, ka ilgstoša (līdz pieciem gadiem pēc kārtas) tamoksifēna lietošana ticami palielina endometrija vēža saslimstības risku, turklāt ar sliktāku prognozi. Turklāt šo risku ietekmēja ne tik daudz tamoksifēna deva, bet gan lietošanas ilgums, kā arī tādi blakusfaktori kā palielināts svars un hormonu aizstājterapijas vienlaikus lietošana. Arī Starptautiskā vēža pētniecības aģentūra (IARC) atzinusi, ka pastāv pietiekoši pierādīta saistība starp tamoksifēna lietošanu un endometrija vēzi, ko pagaidām tik droši nevar apgalvot par citu lokalizāciju audzējiem, kas varētu attīstīties tamoksifēna lietošanas laikā. Apjomīga Zviedrijas pētījuma rezultāti par 2 729 pacientēm liecināja, ka pēcoperācijas profilaktiskā tamoksifēna lietotāju grupā endometrija vēža gadījumi bija pārliecinoši biežāki. Dāņu pētnieki, veicot retrospektīvu analīzi, konstatēja, ka tamoksifēna lietotāju vidū endometrija vēzis attīstījās divas, trīs reizes biežāk nekā nelietotājām.
Ne velti Amerikas Dzemdību speciālistu un ginekologu kolēģija ir izstrādājusi īpašas rekomendācijas tamoksifēna lietotāju regulārai novērošanai, proti:
- reizi gadā veicama onkocitoloģiskā uztriepe un ginekoloģiska bimanuāla rektovagināla izmeklēšana;
- jebkuru neparastu izdalījumu gadījumā no dzimumceļiem veicama dzemdes dobuma aspirācijas biopsija;
- ārstam ir jārēķinās ar endometrija vēža iespējamību tamoksifēna lietotājām;
- pacientēm, kuras tamoksifēnu lieto profilakses nolūkā (bez krūts vēža diagnozes), rūpīgi jāseko, vai neattīstās endometrija hiperplāzija un vēzis;
- atipiskas endometrija hiperplāzijas gadījumā jāpārtrauc tamoksifēna lietošana un jāveic proves abrāzija;
- pacientēm ar atipisku endometrija hiperplāziju, kam pamatslimības dēļ būtu indicēta tamoksifēna terapijas turpināšana, piedāvājama histerektomija;
- pēc histerektomijas var atsākt tamoksifēna terapiju.
NSABP P-1 pētījumā laikā konstatēts, ka tamoksifēna lietotāju vidū atrasti 53 dzemdes adenokarcinomas gadījumi, salīdzinot ar 17 gadījumiem placebo grupā. Tādējādi dzemdes adenokarcinomas rādītāji uz 1 000 sievietēm gadā bija 2,2 tamoksifēna un 0,71 placebo grupā. Ievērojami retāka atrade bija dzemdes sarkoma. Uz tūkstoš sievietēm gadā dzemdes sarkomu atklāja 0,17 gadījumos tamoksifēna lietotāju vidū un nevienā gadījumā placebo grupā.
Teratogēnā darbība [20]
Tamoksifēns ir atzīts par potenciāli teratogēnu vielu un grūtniecības laikā to neiesaka lietot. Tāpat tamoksifēna lietošanas laikā reproduktīva vecuma sievietes noteikti brīdināmas par drošas kontracepcijas (barjeras vai hormonālas metodes) lietošanu. Turklāt, ņemot vērā, ka tamoksifēna un tā aktīvo metabolītu pilnīga eliminācija sagaidāma pēc apmēram diviem mēnešiem, tad sievietēm, kuras pēc tamoksifēna terapijas plāno grūtniecību, to iesaka darīt vismaz divus mēnešus pēc tamoksifēna pēdējās devas ieņemšanas. Ja grūtniecība iestājas tamoksifēna lietošanas laikā, sieviete brīdināma par iespējamām sekām, kas mēdz būt līdzīgas kā pēc ilgstošas dietilstilbestrola lietošanas. Savukārt, sievietēm, kurām tamoksifēnu plānots lietot vēža profilakses nolūkā, vai pacientēm ar duktālu in situ karcinomu tamoksifēna lietošana sākama menstruāciju laikā vienlaikus ar turpmāko kontracepciju. Tiesa, literatūrā nav norādes par epidemioloģiskiem pētījumiem par tamoksifēna lietošanas drošību grūtniecēm, tāpat kā nav zināmi augļa malformācijas gadījumi tām sievietēm, kam tamoksifēns inducējis grūtniecību. Taču ir ziņojumi par grūtniecībām, kas iestājušās tamoksifēna lietošanas laikā 85 pacientēm ar krūts vēzi. Savukārt kādā citā ziņojumā minēts, ka no pavisam 50 grūtniecībām, kas iestājušās tamoksifēna terapijas laikā, 19 beigušās ar vesela bērna piedzimšanu, astoņos gadījumos grūtniecība pārtraukta, desmit gadījumos fiksētas augļa attīstības anomālijas un 13 gadījumos galarezultāts nav zināms.
Barošana ar krūti [21]
Tā kā tamoksifēns pāriet mātes pienā, tad PVO to nerekomendē lietot krūts barošanas laikā, kaut arī drošu pierādījumu par potenciālu kaitējumu zīdainim nav. Vienlaikus divos placebo kontrolētos pētījumos ar 150 sievietēm noskaidrots, ka tamoksifēns ievērojamā mērā nomāc pēcdzemdību laktāciju, to ordinējot 24 stundu laikā pēc dzemdībām 5-18 dienas pēc kārtas.